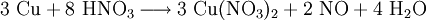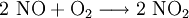Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kupfer(II)-nitrat
Kupfer(II)-nitrat ist das zweiwertige Kupfersalz der Salpetersäure. Produkt-Highlight
EigenschaftenDie Hydrate sind tiefblau, die wasserfreie Substanz ist blaugrün. Lösungen des Stoffes weisen mit zunehmender Konzentration eine Farbänderung von Blau nach Dunkelgrün auf. Die Kristalle zerfließen langsam an der Luft. Außer den genannten Hydraten kann Kupfer(II)-nitrat auch ein Nonahydrat ausbilden, welches aber nur unter ca. -25 °C beständig ist. Beim Erhitzen der Hydrate erfolgt keine Dehydratisierung, sondern es entsteht ab ca. 80 °C basisches Kupfer(II)-nitrat, während bei Temperaturen über 170 °C Kupfer(II)-oxid entsteht. Der Stoff ist wassergefährdend (WGK 2). HerstellungDas Salz kann im Labor sehr einfach durch Einwirken von halbkonzentrierter Salpetersäure auf metallisches Kupfer gewonnen werden. Bei der Reaktion bildet sich am Kupfer gasförmiges Stickstoffmonoxid, während sich die Lösung mit zunehmender Salzkonzentration analog zum Kupferchlorid von Blau nach Grün verfärbt. Das entstandene, farblose Stickstoffmonoxid reagiert sofort mit Luftsauerstoff zum rotbraunen Stickstoffdioxid weiter. VerwendungKupfer(II)-nitrat wird verwendet als Weißblechtinte, zum Schwarzfärben von Kupfer und Brünieren von Eisen. Es wird weiterhin zur Herstellung von Kupferoxid, Korrosions- und Holzschutzmitteln, Flotations- und Bohrhilfsmitteln, in der Färberei und Farbstoffindustrie als Oxidationsmittel, sowie zur Nitrierung organischer Verbindungen verwendet. Quellen
Kategorien: Brandfördernder Stoff | Gesundheitsschädlicher Stoff | Nitrat | Kupferverbindung |
||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kupfer(II)-nitrat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||