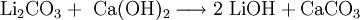Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Lithiumhydroxid
Lithiumhydroxid LiOH, das Hydroxid des Lithiums, ist zwar eine starke, in Wasser aber nur mäßig lösliche Base. Produkt-Highlight
SyntheseReines Lithiumoxid Li2O reagiert mit Wasser zu Lithiumhydroxid. Die technische Herstellung erfolgt durch Umsetzung von Lithiumcarbonat mit Calciumhydroxid: ReaktionsverhaltenLithiumhydroxid ist eine starke Base und reagiert als solche mit Säuren. Außerdem ist Lithiumhydroxid fähig Kohlendioxid zu binden (1 g wasserfreies Lithiumhydroxid bindet 450 ml CO2). VerwendungLithiumhydroxid wird in Akkus, in Fotoentwicklern, zur Darstellung von Boran-Raketentreibstoffen und zur Herstellung stark wasserabweisender Schmierfette auf Lithiumstearatbasis verwendet. Durch seine Eigenschaft, Kohlendioxid zu binden, wird es als Luftreiniger in U-Booten, Fliegeratemgeräten und Raumschiffen verwendet. Im Kühlmittel von Druckwasserreaktoren wird es gegenüber der Borsäure als Alkalisierungsmittel eingesetzt. Quellen
Kategorien: Ätzender Stoff | Lithiumverbindung | Hydroxid |
|||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Lithiumhydroxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||