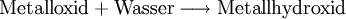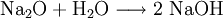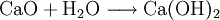Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
HydroxideHydroxide sind salzähnliche Stoffe, die Hydroxid-Ionen (OH−) als negative Gitterbausteine (Anionen) enthalten. Lösliche Hydroxide wie Natriumhydroxid oder Kaliumhydroxid bilden mit Wasser stark alkalische Lösungen (Laugen), die unter der Bezeichnung Natronlauge und Kalilauge bekannt sind. Weniger gut lösliche Hydroxide, z. B. Bariumhydroxid oder Calciumhydroxid bilden mit Wasser schwach alkalische Suspensionen. Die gesättigten Lösungen bezeichnet man als Barytwasser oder Kalkwasser. Wenn diese beiden Stoffe mit Kohlenstoffdioxid in Berührung kommen, trüben sie sich. Produkt-HighlightReaktionsgleichungBeispiel:
Struktur wässriger HydroxidlösungenIn wässriger Lösung ist das Hydroxidion in der Regel von vier bis fünf Wassermolekülen umgeben. Dabei sind vier Wassermoleküle so um das Sauerstoff-Atom des OH− angeordnet, dass sie jeweils eine Wasserstoffbrücke zu diesem ausbilden können (sie zeigen also mit einem Proton auf das OH−). Diese vier Wassermoleküle befinden sich näherungsweise in einer Ebene mit dem OH−-Ion, also in einer anderen Geometrie als bei der (wie bei sp3-Hybridisierung erwartet) annähernd tetraedrischen Anordnung der Elektronenpaare im Wasser und im H3O+. Das OH−-Ion kann mit seinem Proton auch eine – allerdings schwache – Wasserstoffbrücke ausbilden, so dass die Komplexe [OH−(H2O)4] und [OH−(H2O)5] auftreten, je nachdem, ob diese ausgebildet ist oder nicht. Siehe auchKategorien: Stoffgruppe | Hydroxid |
| Dieser Artikel basiert auf dem Artikel Hydroxide aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |