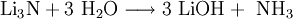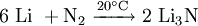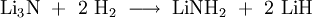Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Lithiumnitrid
Lithiumnitrid ist eine chemische Verbindung, die aus Lithium und Stickstoff aufgebaut ist. Es handelt sich um einen hydrolyseempfindlichen, rotbraunen Feststoff, der mit Wasser zu Lithiumhydroxid und Ammoniak reagiert.[2] Produkt-Highlight
SyntheseLithiumnitrid wird durch Reaktion von Lithium mit Stickstoff hergestellt. Die Reaktion läuft schon bei Raumtemperatur (langsam) ab: StrukturIm Lithiumnitrid bilden die Lithiumatome graphitähnliche hexagonale Schichten, sie sind trigonal-planar koordiniert. In deren Mitte befindet sich jeweils ein Stickstoffatom. Zwischen den Schichten befinden sich weitere Lithiumatome. Jedes Nitridion ist hexagonal bipyrimidal mit 8 Lithium-Ionen koordiniert.[3]
EigenschaftenLithiumnitrid ist ein feines, rot-braunes Pulver mit einer Dichte von 1.38 g·cm-3 bei Standardbedingungen. Es schmilzt bei 845 °C und ist unter Ausschluss von Feuchtigkeit und Luft stabil.[4]. Lithiumnitrid zählt zu den besten Ionenleitern. Allerdings spricht gegen eine Anwendung als Festelektrolyt in Batterien das zu niedrige Zersetzungspotential von 0,45 V. Außerdem ist Lithiumnitrid ein Beispiel für eine Superbase. Das N3--Ion reagiert dabei als Brønsted-Base. Lithiumnitrid kann sogar Wasserstoff deprotonieren. Dabei läuft folgende Reaktion ab: Die Reaktion kann durch Erhitzen umgekehrt werden. VerwendungForscher der National University of Singapore entdeckten, dass Lithiumnitrid bis zu 9.3 % Wasserstoffgas aufnehmen kann. Dabei werden die Wasserstoffatome ins Kristallgitter des Nitrids eingelagert. Für eine Anwendung sind allerdings die notwendigen Temperaturen von 255 °C noch zu hoch.[5][6] Literatur/Referenzen
Kategorien: Feuergefährlicher Stoff | Ätzender Stoff | Lithiumverbindung | Nitrid |
||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Lithiumnitrid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||