Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Lithiumperchlorat
Lithiumperchlorat ist das Lithiumsalz der Perchlorsäure und wie viele Perchlorate bei erhöhter Temperatur ein starkes Oxidationsmittel. Es ist ein farbloser, in Wasser, Alkoholen und einigen anderen Lösungsmitteln leicht löslicher Feststoff. Produkt-Highlight
HerstellungLithiumperchlorat kann aus Perchlorsäure und Lithiumchlorid hergestellt werden. HandhabungHitze, offene Flammen, starke Reduktionsmittel und entzündliche Substanzen sollten aufgrund der Explosionsgefahr vermieden werden. ReaktionenBei 410-430°C zersetzt sich reines Lithiumperchlorat langsam zu Lithiumchlorid und Sauerstoff, schneller bei 450°C:
Verunreinigtes Lithiumperchlorat kann sich schon unterhalb von 300°C in heftiger Reaktion zersetzen. EinsatzbereicheLithiumperchlorat wird technisch nur begrenzt eingesetzt, da es teuer (ca. 200 EUR für 500 g) und schwer zu handhaben ist. Da es in vielen organischen Lösungsmitteln, einschließlich Ethanol und Ether, relativ gut löslich ist, wird es als Elektrolyt verwendet, wobei insbesondere die Anwendung in Lithiumbatterien bedeutend ist. Ein weiteres Beispiel für eine Verwendung als Elektrolyt in nichtwässrigen Lösungen ist die Herstellung von Polypyrrol, das dann auch mit Lithiumperchlorat dotiert werden kann. Da Lithiumperchlorat das günstigste Masse-Volumen-Verhältnis an Sauerstoff unter allen Perchloraten aufweist, wird es in der Luft- und Raumfahrt als Sauerstoffträger geschätzt. QuellenKategorien: Gesundheitsschädlicher Stoff | Brandfördernder Stoff | Lithiumverbindung | Perchlorat |
||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Lithiumperchlorat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||







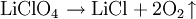 .
.


