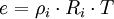Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
DampfdruckDer Dampfdruck ist ein stoff- und temperaturabhängiger Gasdruck. Anschaulich gesprochen ist der Dampfdruck der Umgebungsdruck, unterhalb dessen eine Flüssigkeit beginnt, bei konstanter Temperatur in den gasförmigen Zustand überzugehen. In der Technik hat der Dampfdruck im System Wasser-Luft eine besondere Bedeutung. Produkt-Highlight
DefinitionenStoffe treten in drei Aggregatzuständen auf, nämlich: fest, flüssig und gasförmig. Existiert neben dem Gas noch eine flüssige Phase, so bezeichnet man das Gas als Dampf. Der Dampfdruck ist also der Gasdruck in einem mehrphasigen System. Hält man die Temperatur eines geschlossenen Systems konstant, so stellt sich ein Gleichgewicht zwischen der flüssigen und der gasförmigen Phase ein. Die Gasphase ist gesättigt und man misst den Dampfdruck. Wenn sich das Gleichgewicht vollständig eingestellt hat, spricht man auch von Sättigungsdampfdruck. Wenn die flüssige Phase verschwindet und nur noch eine gasförmige Phase existiert, messen wir keinen Dampfdruck mehr, sondern den Gasdruck. Befinden sich verschiedene Stoffe im betrachteten System, so setzt sich der gemessene Druck der Gasphase aus den Partialdrücken der verschiedenen Stoffe zusammen. Bedingung ist, dass sich diese wie ideale Gase verhalten (Daltonsches Gesetz). Definition im Sinne der ChemieIn der Chemie versteht man unter dem Dampfdruck den Partialdruck eines Gases (Einkomponentensystem), das im thermodynamischen Gleichgewicht mit seiner flüssigen oder festen Phase steht. Definition im Sinne der MeteorologieIn der Meteorologie versteht man als Dampfdruck lediglich den Partialdruck des Gases selbst und dabei in der Regel den des Wasserdampfes (also nicht Stickstoff, Kohlendioxid, ...). Den maximalen Dampfdruck, der bei einer Sättigung herrscht, bezeichnet man hier als Sättigungsdampfdruck, was identisch zur Definition des Dampfdruckes in der Chemie ist. Wasserdampfdruck
Existieren Wasser und Wasserdampf im thermodynamischen Gleichgewicht nebeneinander, so ist der Druck eine reine Funktion der Temperatur:
Dieser temperaturabhängige und stoffspezifische Druck wird als Dampfdruck und der Graph dieser Funktion als Dampfdruckkurve bezeichnet. Die Dampfdruckkurve endet im kritischen Punkt. Bei Erhöhung der Temperatur steigen Dampfdruck und Dampfdichte stark an, während die Dichte der Flüssigkeit abnimmt. Die Eigenschaften von Wasser und Dampf werden mit steigender Temperatur immer ähnlicher, bis am kritischen Punkt bei T = Tc = 374,12 °C und p = pc = 221,2 bar der Unterschied ganz verschwunden ist und nur noch eine einzige Phase existiert. Bei Annäherung an den kritischen Punkt verschwindet die Verdampfungswärme und es treten starke Dichtefluktuationen auf, erkennbar als kritische Opaleszenz. Praktische BedeutungIn einem offenen Topf kocht erhitztes Wasser dann, wenn sein Dampfdruck den Luftdruck der Umgebung übersteigt. Wie der Luftdruck variiert daher auch die Siedetemperatur des (Tee-)Wassers mit dem Wetter und nimmt mit zunehmender Hohe über Normalnull (Meter über dem Meeresspiegel) ab. In 2000 m Höhe kocht das Wasser bereits bei 93 °C, in 8000 m Höhe bei 74 °C (Mittelwerte über wetterbedingte Schwankungen). Die physikalischen Gesetze zu Dampfdruck und Verdampfung (Dampfdruckkurve, Clausius-Clapeyron-Gleichung etc.) wurden zuerst im Zusammenhang mit der Dampfmaschine untersucht und formuliert. Auch hier gibt es eine Koexistenz von Flüssigkeit und Gas. Man machte sich bei der Dampfmaschine die Tatsache zunutze, dass der Dampfdruck unabhängig von dem Volumen ist, solange man sich im Zwei-Phasensystem "Flüssigkeit-Gas" bewegt. Das einzige was sich bei konstanter Temperatur ändert, ist das Mengenverhältnis "Flüssigkeit-Gas". Der Druck im Kessel, der den Kolben bewegt, verändert sich also nicht durch die Kolbenbewegung (Kolbenbewegung ->Volumenänderung im Zylinder). BerechnungDie Berechnung des Sättigungsdampfdrucks kann bspw. über die Methoden nach Lee-Kesler und Ambrose-Walton erfolgen. Beide Methoden basieren auf dem Korrespondenzprinzip, bei dem kritische Daten und der azentrische Faktor benutzt werden. Höhere Genauigkeitsanforderungen genügen die Dampfdruckgleichungen, die stoffspezifische, an experimentelle Daten angepasste Parameter verwenden, wie etwa die Wagner- und die Antoine-Gleichung. Wasserdampfdruck in der MeteorologieIn der Meteorologie wird unter der Bezeichnung Dampfdruck meist der Dampfdruck des Wasserdampfs (Wasserdampfdruck) und somit sein Partialdruck verstanden. Die Dampfdichte entspricht der absoluten Luftfeuchtigkeit. Der Dampfdruck nach Definition der Meteorologie, also der Partialdruck eines Gases innerhalb eines Gasgemisches, kann durch Umstellung der allgemeinen Gasgleichung mit folgender Formel näherungsweise berechnet werden: Die einzelnen Formelzeichen stehen für folgende Größen:
Die individuelle Gaskonstante für Wasserdampf beträgt 461,5 J/(kgK). Da der Wasserdampfpartialdruck nur einen kleinen Teil des Luftdrucks ausmacht, ergibt sich nur nach einem recht langen Zeitraum ein thermodynamisches Gleichgewicht, wodurch wesentliche Untersättigungen in der Atmosphäre möglich sind, ohne dass das vorhandene flüssige Wasser sofort siedet. Aus diesem Grund und der hohen Dynamik in der Atmosphäre sind thermodynamisch stabile Zustände in der Regel selten oder nur kurz anzutreffen, besonders in sehr wetteraktiven Zonen der Erdatmosphäre. Aufgrund des lokal relativ höheren Dampfdrucks über der flüssigen Phase (siehe oben) wachsen bei gleichzeitigem Vorhandensein von Wasser und Eis in einer Wolke die Eispartikel auf Kosten der Wassertröpfchen. Über einer nicht überhitzten festen Phase ist der Dampfdruck geringer als über einer flüssigen Phase gleicher Temperatur. Stehen beide Phasen über die sie umgebenden Gase miteinander in Kontakt, so wächst daher der Anteil des Feststoffes auf Kosten der Flüssigkeit. Dies liegt darin begründet, dass die stärkere Bindung der Teilchen im Feststoff und die daraus resultierende Schmelzwärme im Falle der Sublimation, also des Phasenübergangs fest-gasförmig, zusätzlich überwunden bzw. aufgebracht werden muss. Dies hat zur Folge, dass es leichter und damit häufiger zur Verdunstung bzw. Verdampfung von Teilchen der flüssigen Phase kommt als zur Sublimation von Teilchen über der festen Phase. Es sind also über der Flüssigkeit mehr Teilchen im gasförmigen Zustand anzutreffen als über dem Feststoff, was den Dampfdruck lokal erhöht und zum Anwachsen der festen Phase führt. Siehe auchLiteraturWertetabellen des Wasserdampfdruckes:
Kategorien: Thermodynamik | Stoffeigenschaft |
|
| Dieser Artikel basiert auf dem Artikel Dampfdruck aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |