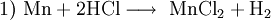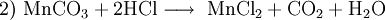Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Mangan(II)-chlorid
Mangan(II)-chlorid ist ein schwach rosarotes Pulver. Die Verbindung besteht aus Mangan und Chlor und liegt gewöhnlich als Tetrahydrat oder auch in wasserfreier Form vor. Produkt-HighlightGewinnung und DarstellungMangan(II)-chlorid-Tetrahydrat lässt sich durch Reaktion von Mangan oder Mangan(II)-carbonat mit konzentrierter Salzsäure herstellen: Beim Erhitzen im trockenen Chlorwasserstoffstrom kann aus dem Tetrahydrat das wasserfreie MnCl2 erhalten werden. EigenschaftenMangan(II)-chlorid bildet blassrosarote hygroskopische Kristalle. Es ist sehr gut löslich in Wasser und Ethanol. In Lösung ist die Farbe auf das Hexaaquomangan(II)-Kation, [Mn(H2O)6]2+, zurückzuführen. Das Tetrahydrat liegt in Form eines oktaedrischen Komplexes vor, in dem die beiden Chlorid-Liganden cis-ständig sind. Mit einem Überschuss an Chloridionen bilden sich die komplexen Anionen MnCl42− (Tetrachloromanganat(II), tetraedrisch) bzw. MnCl64− (Hexachloromanganat(II), oktaedrisch). VerwendungMangan(II)-chlorid wird zur Herstellung von Manganbraun Mn(O)OH und als Ausgangsstoff zur Synthese Mangan-haltiger Katalysatoren verwendet. Kategorien: Gesundheitsschädlicher Stoff | Umweltgefährlicher Stoff | Manganverbindung | Chlorid |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Mangan(II)-chlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||