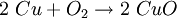Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
MetalloxideMetalloxide sind chemische Verbindungen eines Metalles mit Sauerstoff. Produkt-HighlightNatürliche Metalloxide dienen als Erze zur Metallgewinnung. Ihnen wird durch Verhüttung der Sauerstoff entzogen und so das reine Metall gewonnen. HerstellungMetalle neigen in unterschiedlichem Ausmaß zur Reaktion mit Sauerstoff . Sehr heftig und leicht lassen sich beispielsweise die Alkalimetalle oxidieren. Andere, wie beispielsweise das Eisen, reagieren weniger heftig. Ein Beispiel dafür ist das Rosten von Eisen. Die Edelmetalle wiederum lassen sich kaum bis gar nicht in Metalloxide überführen. EigenschaftenMetalloxide reagieren mit Wasser zu Laugen. Manche Metalloxide bilden mit Wasser sogenannte Amphotere, die sowohl als Lauge als auch als Säure reagieren können, je nach Reaktionspartner. Reaktionsgleichungz.B. Kupferoxid: |
| Dieser Artikel basiert auf dem Artikel Metalloxide aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |