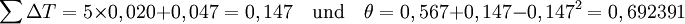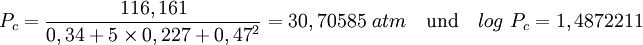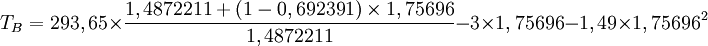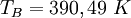Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Pailhes-MethodeDie Pailhes-Methode[1] ist ein Verfahren zur Abschätzung des Normalsiedepunkts TB aus einem bekannten Siedepunkt bei einer niedrigen Temperatur, dem kritischen Druck Pc und einem Verhältnis TB/Tc, das aus der Lydersen-Methode bestimmt werden kann. Die Methode dient vor allem dazu, bei hochsiedenden Komponenten, deren Normalsiedepunkt nicht oder nur schwer experimentell bestimmt werden kann, diese für viele Abschätzverfahren wichtige Größe trotzdem, zumindest mit einiger Genauigkeit, bestimmen zu können. Produkt-Highlight
Bestimmungsgleichungen
mit
BeispielrechnungFür n-Butylacetat (Essigsäurebutylester) gilt folgende Rechnung:
Nach Lydersen gelten folgenden Gruppenbeiträge für Tc: Damit ergibt sich
Mit der Molaren Masse MW=116,161 g·mol-1 ergibt sich der kritische Druck zu
Mit Psat=1,7732 kPa bei Tsat=293,65 K[2] ergibt sich
Damit sind alle benötigten Werte bestimmt und die Bestimmungsgleichung kann besetzt werden:
In der Literatur[3] veröffentlichte Normalsiedepunkte liegen zwischen TB=397,65 K und TB=399,85 K. Siehe auchLiteratur
|
|
| Dieser Artikel basiert auf dem Artikel Pailhes-Methode aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





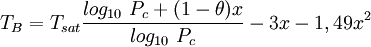
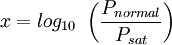
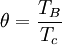 wird in der Originalveröffentlichung ebenso wie der kritische Druck Pc mit der Lydersen-Methode berechnet. Sowohl θ als auch Pc können jedoch auch mit anderen geeigneten Verfahren bestimmt werden.
wird in der Originalveröffentlichung ebenso wie der kritische Druck Pc mit der Lydersen-Methode berechnet. Sowohl θ als auch Pc können jedoch auch mit anderen geeigneten Verfahren bestimmt werden.
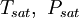 ist ein bekannter Sättigungsdampfdruck bei einer niedrigen Temperatur, oft in der Nähe der
ist ein bekannter Sättigungsdampfdruck bei einer niedrigen Temperatur, oft in der Nähe der