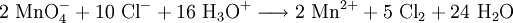Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
PermanganatePermanganate (auch Tetraoxomanganate(VII)) sind Salze der allgemeinen Formel M1MnO4. Produkt-Highlight
StrukturPermanganate leiten sich von der in verdünnter wässriger Lösung beständigen Permangansäure mit der Summenformel HMnO4 ab. Permangansäure lässt sich im Vakuum bis etwa 20 % aufkonzentrieren. Ihre elektrische Leitfähigkeit deutet auf eine starke Dissoziation hin. Eine sehr reine Lösung der Permangansäure lässt sich unter anderem durch tropfenweisen Zusatz, des zugrunde liegenden Anhydrids Dimanganheptoxid mit der Summenformel Mn2O7, zu einer großen Menge gut gekühlten Wassers erhalten. [1] VerwendungDie Permanganate sind wasserlöslich und bilden violette Lösungen, am bekanntesten ist das Kaliumpermanganat. Es sind starke Oxidationsmittel. Mit ihrer Hilfe können beispielsweise Alkene über die entsprechenden Glycole in Carbonsäuren überführt werden. Eine typische Reaktion des Permanganats als Oxidationsmittel ist die Oxidation von konzentrierter Salzsäure zu Chlorgas, wobei das Permanganat selbst zu Mangan(II) reduziert wird: Permanganate werden auch zur Reinigung von organischen Flüssigkeiten sowie der Abluft und der Abwässer in der pharmazeutischen und chemischen Industrie verwendet. Siehe auch
Quellen
|
|
| Dieser Artikel basiert auf dem Artikel Permanganate aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |