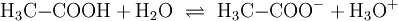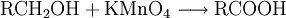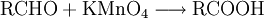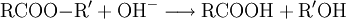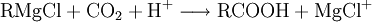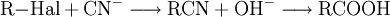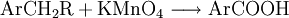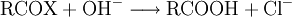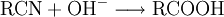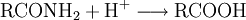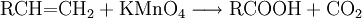Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
CarbonsäurenCarbonsäuren sind organische Verbindungen, die eine oder mehrere Carboxylgruppen (–COOH) tragen. Ihre Salze werden Carboxylate und ihre Ester in der Regel Carbonsäureester genannt. Produkt-Highlight
VorkommenViele Verbindungen tragen unsystematische Namen (Trivialnamen), die meist auf das Wort -säure enden. Der Name selbst weist gelegentlich auf den Ort wo oder aus welcher Substanz die Carbonsäure gewonnen werden kann. (Ameisensäure, Buttersäure, Zitronensäure) EinteilungNach der chemischen Struktur des Restes R, an welchen die Gruppe –COOH gebunden ist, unterscheidet man zwischen aliphatischen, aromatischen und heterocyclischen Carbonsäuren. Die aliphatischen Carbonsäuren lassen sich in Alkansäuren, Alkensäuren und Alkinsäuren unterteilen. Alkansäuren nennt man auch gesättigte Carbonsäuren. Alkensäuren, also Carbonsäuren mit mindestens einer Doppelbindung im Rest und Alkinsäuren mit mindestens einer Dreifachbindung im Rest, nennt man hingegen ungesättigte Carbonsäuren. Neben der Struktur des Restes lassen sich die Carbonsäuren nach Anzahl der Carboxylgruppen unterscheiden. Monocarbonsäuren verfügen über eine Carboxylgruppe, während Dicarbonsäuren zwei und Tricarbonsäuren drei Carboxylgruppen tragen. Weiterhin gibt es Ketocarbonsäuren und Hydroxycarbonsäuren. Fettsäuren sind unverzweigte, aliphatische Monocarbonsäuren mit mindestens 4 Kohlenstoffatomen. Als Harzsäuren bezeichnet man Carbonsäuren, die in Natur-Harzen vorkommen. Metallacarbonsäuren sind Komplexe mit einem Caboxyl-Ligand. Beispiele
EigenschaftenDie chemischen und auch die physikalischen Eigenschaften der Carbonsäuren werden deutlich von der Carboxyl-Gruppe bestimmt. Die Carboxyl-Gruppe erlaubt die Freisetzung von H+-Ionen, hier anhand von Essigsäure dargestellt: Diese Acidität ist im Vergleich zu anorganischen Säuren vergleichsweise schwach. Der saure Charakter der Carbonsäuren entsteht durch die Mesomerie-Stabilisierung des Carboxylat-Anions. Die Stabilität des Anions begünstigt die deprotonierte Form der Carbonsäure. Die Acidität einer Carbonsäure liegt höher, wenn am alpha-C-Atom ein Substituent mit einem elektronenziehenden, also mit induktiven Effekt (−I-Effekt) vorliegt. Der Carboxyl-Gruppe wird so eine positivere Partialladung zugeführt, welche die negative Ladung des Anions stärker ausgleichen, also stabilisieren kann. Beispiel dafür wäre Acetat im Vergleich zu Trichloracetat. Die kurzkettigen Carbonsäuren sind farblose, stark riechende Flüssigkeiten. Sie haben durch die Carboxyl-Gruppe einen polaren Charakter, was zu relativ hohen Siedetemperaturen aufgrund der Wasserstoffbrückenbindungen führt. Aufgrund einer speziellen räumlichen Anordnung führt die Wasserstoffbrückenbindung zu Carbonsäure-Dimeren, was zur doppelten Masse der Teilchen im Dampfraum über der Flüssigkeit führt. Die höhere Masse führt zu einer Erhöhung des Siedepunktes von Carbonsäuren. Mit zunehmender Kettenlänge nimmt der lipophile Charakter zu und der hydrophile Charakter damit ab. Das gilt auch für die Salze der Carbonsäuren. Die Moleküle der häufigsten Fettsäuren besitzen 16 oder 18 Kohlenstoffatome. Ihre Triglycerid-Ester sind die Fette. Die Natrium- und Kalium-Salze der Fettsäuren zeigen die Eigenschaften eines Tensids und werden als Kernseife und Schmierseife verwendet. HerstellungCarbonsäuren entstehen durch Oxidation aus primären Alkoholen, wobei als Zwischenstufen Aldehyde auftreten. Oxidationsmittel: Kaliumpermanganat, Chromtrioxid, Salpetersäure
Spektroskopie von CarbonsäurenDie wichtigsten analytischen Methoden zur Strukturaufklärung von Carbonsäuren sind die IR- und NMR-Spektroskopie. Im IR-Spektrum sind die C=O-Valenzschwingung bei ca. 1710–1760 cm−1 und die breite OH-Valenzschwingung um 3000 cm−1 charakteristisch. Im 1H-NMR-Spektrum sind die aciden Hydroxy-Protonen zu ungewöhnlich niedrigem Feld verschoben, 10–13 ppm. Die Protonen am Carbonyl-C haben eine chemische Verschiebung im Bereich von ca. 2,0–2,5 ppm, eine Ausnahme bildet hier Ameisensäure mit 8,08 ppm. In einer C-Kette einer nicht konjugierten Carbonsäure sind die Peaks, die weiter von der Carbonylfunktion entfernt sind, mit zunehmendem Maße weniger stark tieffeld verschoben, weil der Einfluss des induktiven Effekts der Carbonylgruppe abnimmt. Im 13C-NMR-Spektrum findet man das Carboxyl-C im Bereich von ca. 170–180 ppm. Wichtige ReaktionenGegeben durch die zwei Nachbarsauerstoffatome, die elektronenziehend wirken, können nucleophile Angriffe auf das Kohlenstoffatom stattfinden. Sind die Nucleophile Brønsted-Basen wird allerdings unter Deprotonierung nur das Salz der Carbonsäure entstehen. VeresterungBei der Veresterung reagiert die COOH-Gruppe einer organischen Säure und die OH-Gruppe eines Alkohols. Unter Abspaltung von Wasser entsteht dabei ein Ester. Allgemein sei R1 der Rest der Säure, und R2 der Rest des Alkohols. Dann findet folgende Gleichgewichtsreaktion statt: DehydratisierungCarbonsäuren bilden unter Wasserabspaltung (Dehydratisierung) organische Säureanhydride. Diese können mit Wasser wieder zu den entsprechenden Carbonsäuren zurück reagieren. Kategorien: Stoffgruppe | Carbonsäure |
|||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Carbonsäuren aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |