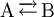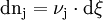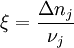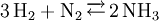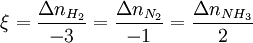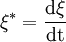Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ReaktionslaufzahlDie Reaktionslaufzahl ξ ist ein Maß für den Ablauf einer chemischen Reaktion. Sie gibt an, wie weit die in der Reaktionsgleichung beschriebene Reaktion fortgeschritten ist. Sie wird auch als "Anzahl der Formelumsätze" bezeichnet. Ein Formelumsatz ist dabei der Ablauf genau einer Reaktion. Auch wenn der Name Reaktionslaufzahl eine dimensionslose Größe suggeriert, trägt sie die Einheit mol. Produkt-HighlightBetrachtet man eine Reaktion
so entspricht ξ = 0 reinem Edukt A, während ξ = 1 mol angibt, dass 1 mol A verschwunden und 1 mol Produkt B entstanden ist. Die Reaktionslaufzahl beschreibt also die Änderungen der Stoffmengen der einzelnen Komponenten während einer Reaktion. ξ muss sich jedoch nicht in Größenordnungen zwischen null und ein mol bewegen, wie aus unten stehenden Formeln ersichtlich ist.
Ändert sich die Reaktionslaufzahl um dξ (d steht für eine unendlich kleine, so genannte differenzielle Änderung), so hat das eine Veränderung der Stoffmenge n um dn zur Folge. Aus einer Umformung der obigen Gleichung ergibt sich die Definition der Reaktionslaufzahl:
Aus dieser Gleichung lässt sich erkennen, dass die stöchiometrischen Koeffizienten nur pseudo-dimensionslos sind, da sich bei genauer Betrachtung eine Einheit der Form molJ / molFormelumsatz ergibt. Die Reaktionslaufzahl nimmt unter Verwendung der gängigen Vorzeichenkonvention (stöchiometrische Koeffizienten der Edukte negativ, die der Produkte positiv) sinnvollerweise immer positive Werte an. Für ein und die selbe Reaktion in dem selben Prozess gibt es genau eine Reaktionslaufzahl, was an folgendem Beispiel verdeutlicht werden soll: Die Reaktionslaufzahl ergibt sich hier zu:
Die Geschwindigkeit einer chemischen Reaktion lässt sich mit Hilfe der Reaktionslaufzahl wie folgt definieren:
|
| Dieser Artikel basiert auf dem Artikel Reaktionslaufzahl aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |