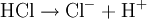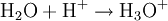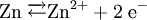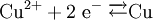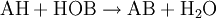Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Chemische Reaktion
Eine chemische Reaktion ist der Vorgang, bei dem aus chemischen Verbindungen (den „Edukten“ oder „Reaktanten“) andere chemische Verbindungen (die „Produkte“) entstehen, indem die Atome der Reaktanten andere Bindungen eingehen. Dabei wird Energie umgewandelt (endotherme Reaktion) oder freigesetzt (exotherme Reaktion), man spricht von der Reaktionsenthalpie. Die Reaktion unterliegt dabei den Gesetzen der Energieerhaltung und der Entropie. Der Vorgang endet, wenn ein Chemisches Gleichgewicht erreicht ist oder die Reaktanten komplett umgewandelt worden sind. Der Ablauf chemischer Reaktionen wird als Reaktionsschema oder Reaktionsgleichung dargestellt:
Produkt-HighlightGrundlagenBei der chemischen Reaktion werden chemische Bindungen gelöst und neue geknüpft. Die spezifischen Eigenschaften der Ausgangsstoffe verschwinden dabei. Die neuentstandenen Stoffe verfügen über andere spezifische Eigenschaften, wie z. B. Farbe, Geruch, Viskosität, Dichte, Festpunkt, Siedepunkt, optische Aktivität usw. Jede Reaktion hat eine andere Reaktionsgeschwindigkeit. Ihr Mechanismus verläuft nach Prinzipien wie Stoffvereinigung (Synthese, Additionsreaktion), Stoffzerlegung (Analyse, Eliminierungsreaktion) und Stoffumgruppierung (Austausch- und Substitutionsreaktionen: Redoxreaktion, Säure-Base-Reaktion (Protolyse), Komplexbildungsreaktion/Ligandenaustausch, Fällungsreaktion/Niederschlagsbildung, organische Substitution (radikalisch, elektrophil, nukleophil). Abgrenzung zu physikalischen Vorgängen
Bei einer chemischen Reaktion entsteht mindestens ein neuer Stoff (Produkt) - bei physikalischen Vorgängen ändern sich nicht die stoffspezifischen sondern nur physikalische Eigenschaften wie Wärmeinhalt, Aggregatzustand und Ausdehnung. Alle chemischen Reaktionen sind jedoch auch von physikalischen Veränderungen der Stoffe begleitet. Es sind Abgabe oder Aufnahme von Energie, Änderungen des Aggregatszustandes oder der Farbe beobachtbar. (Die Unterscheidung zwischen chemischer Reaktion und physikalischem Vorgang ist in Ausnahmefällen nicht ganz klar definierbar; so gilt die Auflösung von Natrium in verflüssigtem Ammoniakgas als chemische Reaktion, da sich die Flüssigkeit blau färbt. Nach dem Eindampfen des Ammoniaks bleibt jedoch Natrium übrig und nicht - wie im Fall einer chemischen Reaktion zu erwarten wäre - irgendeine Verbindung aus Natrium und Stickstoff.) Unabhängig vom hier gesagten lassen sich Reaktionen jedoch auch mit physikalischen Mitteln beschreiben. StoffumwandlungBei einer chemischen Reaktion werden chemische Stoffe in andere Stoffe umgewandelt. Je nach dem, ob Elemente oder Verbindungen bei den Edukten oder Produkten auftreten, unterscheidet man zwei Reaktions-Grundtypen: SyntheseStoffvereinigung - Zwei Elemente treten zu einer Verbindung zusammen: Beispiele: 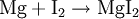
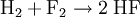
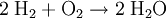 AnalyseStoffzerlegung - Eine Verbindung wird in ihre Elemente zerlegt: Beispiel: Wasser wird durch Elektrolyse oder bei 2000°C in Sauerstoff und Wasserstoff zerlegt: 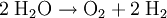 Alle anderen Reaktionstypen (Stoffumgruppierungen) lassen sich aus Analyse und Synthese zusammensetzen: Einfache UmsetzungHier reagiert ein Element mit einer Verbindung, wobei ein anderes Element und eine neue Verbindung entstehen:
Beispiel: Elementares Chlor setzt aus Natriumiodid elementares Iod frei und es bildet sich Natriumchlorid (Kochsalz): 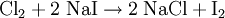 Das entstandene Iod wird dann mit dem Lösungsmittel Hexan ausgeschüttelt (Extraktion) und färbt es rosaviolett (Nachweisreaktion). Ähnlich reagiert Chlorwasser auch mit Natriumbromidlösung; beigefügtes Hexan färbt sich dann orange statt rosaviolett. Eine einfache Umsetzung kann man aus den beiden Teilreaktionen Analyse und Synthese zusammengesetzt vorstellen: Analyse: BC → B + C
Synthese: A + C → AC
Summengleichung: A + BC → AC + B
Doppelte UmsetzungHier reagieren zwei Verbindungen so miteinander, dass zwei neue Verbindungen entstehen: Beispiel: Wird eine Lösung von Magnesiumiodid mit einer Lösung von Bleichlorid vermischt, fällt gelbes Bleijodid aus, in der Lösung bleibt Magnesiumchlorid zurück. 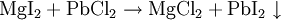 Ein doppelte Umsetzung kann man sich aus zwei Analyse- und zwei Synthesereaktionen zusammengesetzt vorstellen: Analyse 1: AB → A + B
Analyse 2: CD → D + C
Synthese 1: A + D → AD
Synthese 2: B + C → CB
Summengleichung: AB + CD → AD + CB
Weitere Möglichkeiten
Donator-Akzeptor-PrinzipSäure-Base-Reaktionen, Redoxreaktionen und Komplexbildungsreaktionen lassen sich auf das Donator-Akzeptor-Prinzip zurückführen. In diesen Fällen entstehen die Produkte durch Austausch von Elementarteilchen zwischen den Edukten. Säure-Base-ReaktionenDiese Reaktionen beruhen auf einem Austausch von Protonen zwischen den Edukten. Sie können als Sonderfall einer doppelten Umsetzung (siehe oben) angesehen werden. Als Edukte dienen stets eine Säure und eine Base. Die Säure als Protonendonator gibt dabei mindestens ein Proton an die Base als Protonenakzeptor ab. Beispiel: Beim Auflösen von Chlorwasserstoffgas in Wasser entsteht Salzsäure. Hierbei dient der Ampholyt Wasser als Base. 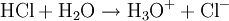 Säure-Base-Reaktionen lassen sich in zwei Teilreaktionen zerlegen, die beide als Protolyse bezeichnet werden:
Beispiel: Chlorwasserstoffgas reagiert mit Ammoniakgas zu festem Ammoniumchlorid (Salmiak). 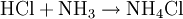 Beispiel: Ammoniak reagiert mit dem Ampholyt Wasser, das jetzt als Säure fungiert, zu einer basischen Lösung. 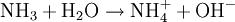 Einen Sonderfall der Säure-Base-Reaktion stellt die Neutralisation dar, bei der eine saure Lösung mit einer basischen Lösung zu einer neutralen Lösung reagiert. Die eigentliche neutralisierende Reaktion besteht darin, dass Oxonium(Hydronium)ionen der Säure als Protonendonatoren mit Hydroxidionen der Base als Protonenakzeptoren zu neutralem Wasser reagieren: 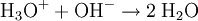 Verdrängungsreaktionen: Die stärkere Säure (beziehungsweise Base) verdrängt die schwächere Säure (beziehungsweise Base) beziehungsweise deren gasförmiges Anhydrid aus deren Salzen. (Beispiele: Schwefelsäure setzt aus Sulfiten Schwefeldioxid und aus Chloriden Chlorwasserstoff frei, konzentrierte Chlorwasserstoffsäure setzt aus Sulfiden Schwefelwasserstoff und aus Cyaniden Cyanwasserstoff frei; Ätznatron setzt aus Aminen und Ammoniumverbindungen Ammoniak frei. RedoxreaktionenDiese Reaktionen beruhen auf einem Austausch von Elektronen zwischen den Edukten. Sie können allen vier Grundformen chemischer Reaktionen zu Grunde liegen. Als Edukte dienen stets ein Reduktionsmittel und ein Oxidationsmittel. Das Reduktionsmittel als Elektronendonator gibt dabei mindestens ein Elektron an das Oxidationsmittel als Elektronenakzeptor ab. Beispiel: Auf einem Zinkstab (Reduktionsmittel), der in eine Lösung mit Kupfer-II-Ionen (Oxidationsmittel) taucht, scheidet sich elementares Kupfer ab (siehe Zementation). Die Lösung wird mit Zink-II-Ionen angereichert. 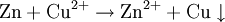 Redoxreaktionen lassen sich in die Teilreaktionen Oxidation und Reduktion zerlegen:
Verbrennungen sind Redoxreaktionen, die stets elementaren Sauerstoff als Oxidationsmittel aufweisen. Bei der Gewinnung von Metallen aus Erzen wird als Reduktionsmittel Kohlenstoff oder Kohlenstoffmonoxid eingesetzt (siehe Eisengewinnung). KomplexbildungsreaktionenBei einer Komplexbildungsreaktion werden ebenfalls Elektronen ausgetauscht - hier allerdings werden sie einem Zentralatom (zumeist ein Kation als Lewis-Säure) von Molekülen oder Ionen in Form von freien Elektronenpaaren zur Verfügung gestellt (dem Liganden als Lewis-Base. So reagieren zum Beispiel Kupfer-II-ionen mit Ammoniaklösung: ![\mathrm{Cu^{2+} + 4\;NH_3 \rightarrow [Cu(NH_3)_4]^{2+}}](images/math/8/3/b/83b8c49642b4e72f5cea71966609f204.png) Erhaltungssätze bei chemischen Reaktionen
Folgerungen hieraus:
Energetische Betrachtungen
Jede chemische Reaktion läuft unter Energiebeteiligung ab, da das Lösen und Knüpfen chemischer Bindungen mit Energieumwandlungen verbunden ist. Beteiligte EnergieformenAuf Grund der Art der beteiligten Energie lassen sich verschiedene Reaktionstypen unterschieden:
Reaktionsweg und EnergiebilanzDie Thermodynamik einer Reaktion beschreibt den Ablauf einer Reaktion aus energetischer Sicht. Ein chemisches System ist bestrebt, einen möglichst energiearmen Zustand (Enthalpie-Minimum) und einen möglichst hohen Unordnungsgrad (Entropie-Maximum) einzunehmen. Ablauf einer exothermen ReaktionDie Edukte befinden sich zunächst in einem metastabilen Zustand. Durch kurze Zufuhr eines bestimmten Energiebetrags, der Aktivierungsenergie (Aktivierungsenthalpie), wird das System in den instabilen Zustand gehoben. Durch die Aktivierung kommt die Reaktion in Gang und läuft ohne weitere Energiezufuhr selbständig ab. In der Gesamtbilanz gibt das chemische System Energie an die Umgebung ab, sie wird als Reaktionsenthalpie bezeichnet. Die Produkte befinden sich jetzt in einem stabilen Zustand. (Zur Stabilität von Systemen siehe auch Systemeigenschaften)
Beispiel: Kohle verbrennt mit dem Sauerstoff der Luft unter Wärmeentwicklung (exotherm) zu Kohlenstoffdioxid. 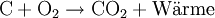
Ist die Aktivierungsenergie sehr niedrig, kann die Reaktion bereits ohne zusätzliche Energiezufuhr von außen in Gang gesetzt werden. Die notwendige Aktivierungsenergie wird der Umgebung entzogen. Die Reaktion läuft spontan ab. Ablauf einer endothermen ReaktionenDie Edukte befinden sich zunächst in einem stabilen Zustand. Durch andauernde Zufuhr eines bestimmten Energiebetrags, der Summe aus Aktivierungsenergie und Reaktionsenergie, wird das System in den instabilen Zustand gehoben. Wird die Energiezufuhr unterbrochen, bleibt auch die Reaktion stehen. In der Gesamtbilanz nimmt das chemische System Energie aus der Umgebung auf, sie wird als Reaktionsenergie bezeichnet. Die Produkte befinden sich jetzt in einem metastabilen Zustand.
Ein Beispiel für eine endotherme Reaktion ist die Reaktion von Kupfer und Schwefel zu Kupfersulfid. Andere Beispiel sind die Reaktion von Eisen und Schwefel zu Einsensulfid etc. Metalle und Schwefel reagieren immer zu Metallsulfiden. KatalyseDurch Einsatz von Katalysatoren kann die Aktivierungsenthalpie sowohl bei endothermen als auch bei exothermen Reaktionen gesenkt werden. Bei der Autokatalyse wirken die entstehenden Produkte als Katalysatoren für ihre Bildung. Beispiel: Autokatalytische Bildung von Silber im Entwicklerbad, siehe dazu Fotografie.): ![\mathrm{Ag^+ + e^- \begin{matrix} \left[ Ag \right] \\ \longrightarrow \end{matrix} Ag}](images/math/4/9/1/4915b239e682d5136f4470c36078d90d.png) Endergone und exergone ReaktionenWird bei einer Reaktion die Entropieänderung mit einbezogen, wird für energetische Betrachtungen die Gibbs-Helmholtz-Gleichung benötigt: 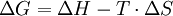 T = Temperatur in Kelvin ΔG = Änderung der freien Enthalpie ΔS = Entropieänderung (bei 298 K) aus ΔS = Σ{S(Produkte)} - Σ{S(Edukte)} ΔH = Enthalpieänderung (bei 298 K) aus ΔH = Σ{H(Produkte)} - Σ{H(Edukte)} Bei endergonen Reaktionen ist ΔG positiv, bei exergonen Reaktionen ist ΔG negativ. Eine chemische Reaktion läuft nur dann von selbst ab, wenn die freie Reaktionsenthalpie ΔG negativ ist. Interpretationsmöglichkeiten der freien Enthalpie:
Statistische BetrachtungenManche chemische Reaktionen laufen nur sehr langsam oder gar nicht ab, obwohl sie aus thermodynamischer Sicht möglich wären. Durch geeignete Reaktionsbedingungen lassen sich aber auch diese Reaktionen beschleunigen (siehe Reaktionsgeschwindigkeit (Chemie)):
Die kinetische Gastheorie der Physik stellt einen wichtigen Beitrag zur Modellierung der Bedingungen einer chemischen Reaktion auf der Ebene der kleinsten Teilchen dar.
Möglichkeiten zur Erhöhung der Wahrscheinlichkeit eines „erfolgreichen“ Zusammenstoßes: 1. Temperaturerhöhung: Je höher die Temperatur ist, umso mehr Teilchen weisen die erforderliche Mindestenergie oder mehr auf. 2. Konzentrationserhöhung: Je höher die Konzentration der Reaktionspartner ist, desto wahrscheinlicher ist es, dass Teilchen mit der passenden Energie zusammentreffen. Da im Laufe der Reaktion die Konzentration der Edukte abnimmt und die Konzentration der Produkte zunimmt, nimmt die Reaktionsgeschwindigkeit mit der Zeit ab. Die Optimierung dieser Reaktionsbedingungen hat besonders im industriellen und großtechnischen Maßstab eine herausragende Bedeutung. Zur detaillierten Darstellung der Gesetzmäßigkeiten siehe Kinetik, Reaktionskinetik, Enzymkinetik Reversible Reaktionen – GleichgewichtsreaktionenEs gibt chemische Reaktionen, die nicht vollständig ablaufen. Auch wenn man die Edukte im stöchiometrischen Verhältnis mischt, liegen am Ende der Reaktion noch immer Edukte vor. Beispiel: Ein stöchiometrisches Gemisch von hellgelber Eisen-III-chlorid- und farbloser Kaliumrhodanid-Lösung reagiert zu tiefrotem Eisenrhodanid („Theaterblut“). Wird nach einiger Zeit zusätzlich Eisenchlorid hinzugegeben, kommt es zu einer Farbvertiefung. Das bedeutet, dass noch unverbrauchtes Kaliumrhodanid vorlag. Ebenso gelingt eine Farbvertiefung durch Zugabe von Kaliumrhodanid. Chlorwasserstoff reagiert mit Wasser praktisch vollständig in einer Säure-Base-Reaktion. Nach Ablauf der Reaktion liegen keine Chlorwasserstoffmoleküle (H-Cl) mehr vor, sondern nur noch Chlorid- (Cl-) und Oxoniumionen (H3O+) als Produkte. Chlorwasserstoff dissoziiert in Wasser praktisch vollständig, sein Dissoziationsgrad beträgt 100 %. (Dieses Gemisch wird als Salzsäure bezeichnet.) Essigsäure dagegen dissoziiert nicht vollständig in Wasser, am Ende der Reaktion liegen noch 99,96 % undissoziierte Ethansäure-Moleküle vor, die übrigen haben mit Wasser zu Acetat-Ionen reagiert. Beobachtungen dieser Art haben zum Konzept der umkehrbaren (reversiblen) chemischen Reaktionen und zum chemischen Gleichgewicht geführt: Prinzipiell sind alle chemischen Reaktionen umkehrbar, die Produkte können wieder zu Edukten zurückreagieren. Die Reaktion von den Edukten zu den Produkten wird Hinreaktion, die von den Produkten zurück zu den Edukten Rückreaktion genannt. In der Reaktionsgleichung wird die Reversibilität einer Reaktion durch den „chemischen“ Doppelpfeil dargestellt: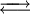 Die Definition der Hinreaktion entspricht der Leserichtung von links nach rechts. Die Rückreaktion entspricht dann der umgekehrten Leserichtung. Beispiele:
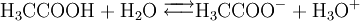
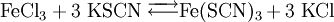 Werden für reversible Reaktionen die Versuchsbedingungen nicht geändert, stellt sich nach einiger Zeit ein chemisches Gleichgewicht ein. Die Konzentrationen der Edukte und Produkte verändern sich nicht mehr, obwohl Hin- und Rückreaktion noch weiter ablaufen. Diese unveränderlichen Gleichgewichtskonzentrationen stehen in einem für die Reaktion und die Reaktionsbedingungen charakteristischen Verhältnis zu einander. Näheres hierzu siehe unter chemisches Gleichgewicht, Gleichgewichtskonstante, Säurekonstante, Massenwirkungskonstante, Massenwirkungsgesetz, Fließgleichgewicht). Bei scheinbar vollständig ablaufenden Reaktionen, wie zum Beispiel Chlorwasserstoff in Wasser, liegt das Gleichgewicht praktisch auf der Seite der Produkte. Die Hinreaktion ist begünstigt, die Rückreaktion läuft praktisch nicht ab. Für die Reaktion von Essigsäure mit Wasser liegt das Gleichgewicht auf der Seite der Edukte. Hier hat die Rückreaktion einen stärkeren Einfluss auf die Gleichgewichtslage als die Hinreaktion. Für Edukte, die nicht miteinander reagieren, liegt das Gleichgewicht praktisch vollständig auf der Seite der Edukte. Chemische Reaktionsarten und -typenEs gibt verschiedene Arten von chemischen Reaktionen:
Bei Additionen treten zwei Moleküle zu einem einzigen zusammen. (Gegenteil: Zersetzung)
Bei Kondensationen treten zwei Moleküle zu einem einzigen zusammen und stoßen dabei kleine Moleküle wie Wasser oder Ammoniak ab. (Gegenteil: Hydrolyse) Bei Polykondensationen und Polyadditionen reagieren viele kleine Moleküle (Monomere) zu Riesenmolekülen (Polymere). So entstehen z. B. aus Aminosäuren Eiweiße.
Weiterführende Themen
Siehe auchLiteratur
Chemische Reaktionen und deren Durchführung z.B. im Labor / in Form von Nachweisreaktionen lehren und beschreiben auch:
Kategorien: Chemische Reaktion | Nachweisreaktion |
||||
| Dieser Artikel basiert auf dem Artikel Chemische_Reaktion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |