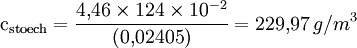Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Verbrennung (Chemie)Eine Verbrennung ist eine Redoxreaktion unter Abgabe von Wärme, insbesondere auch von Licht und flüchtigen Stoffen. Im allgemeinen Sprachgebrauch versteht man unter einer Verbrennung die Redoxreaktion eines Materials mit Luftsauerstoff. Zu unterscheiden ist eine Verbrennung in Form eines Feuers mit Flammenerscheinung von einer unvollständigen Verbrennung (Schwelbrand, Verkokeln), sowie langsamen und relativ kalten Oxidation, etwa beim Verrosten von Metallen oder innerhalb eines Lebewesens bei der „Verbrennung“, also der Oxidation von Nährstoffen, ablaufen. Die Verbrennung in einem Feuer kann kontrolliert (Nutzfeuer), zum Beispiel in einem Ofen, einem Dampfkessel Feuerung oder Lagerfeuer, oder unkontrolliert (Schadfeuer) bei einem Brand erfolgen. Brennbare Stoffe werden in der Brandlehre in fünf verschiedene Brandklassen eingeteilt. Verbrennungen, die mit einer hohen Verbrennungsgeschwindigkeit, nahezu schlagartig und mit enormer Volumenzunahme (der gasförmigen Bestandteile) erfolgen, bezeichnet man als Explosionen, welche unter Berücksichtigung der Verbrennungs- und Ausbreitungsgeschwindigkeit in Detonation (Detonationsgeschwindigkeit der Sprengtechnik), Deflagration und Verpuffung (Abbrandgeschwindigkeit der Pyrotechnik) unterteilt werden (siehe auch Brisanz). Das Zünden: Während allgemein Verbrennungen entzündet werden, werden insbesondere Feuer, Deflagrationen, u. a. angezündet, Detonationen gezündet (siehe Zünder), Dämpfe und Gase entflammt. Produkt-Highlight
VerlaufBei der Verbrennung reagiert eine Substanz chemisch mit Sauerstoff oder (selten) einem anderen Gas. Die Substanz kann fest (beispielsweise Holz, Kohle), flüssig (Benzin, Alkohol), flüssig werdend (Wachs) oder gasförmig (Methangas, Erdgas) sein. Oft wird bei Verbrennung Licht freigesetzt. Außerdem erhöht sich typischerweise die Temperatur sehr stark, was zur Heizung oder Verrichtung von Arbeit genutzt werden kann.
Voraussetzungen für eine VerbrennungVorhanden sein muss:
Ein Katalysator kann die Verbrennung beschleunigen oder sogar erst ermöglichen. Ebenso kann Verbrennung durch Zufuhr von Wärme eingeleitet werden. Verbrennung von Holz und anderer organischer FeststoffeDie Verbrennung von Holz beginnt mit einer Erhitzung von außen. Enthält das Holz Wasser, dann stoppt die Temperaturerhöhung oberhalb von 100 °C (je nach Siedepunktserhöhung durch gelöste Stoffe). Erst wenn das meiste Wasser verdampft ist, kann sich die Temperatur weiter erhöhen und die Verbrennung beginnen. Für die Verdampfung von Wasser müssen große Wärmemengen zugeführt werden. Weil Holz ungefähr das eigene Gewicht an Wassermengen speichern kann, ist das Anzünden von feuchtem oder nassem Holz langwierig bis unmöglich. Ist das Holz getrocknet, so erhöht sich die Temperatur weiter, bis das Holz ab etwa 150°C beginnt zu verkohlen. Hierbei verwandelt sich das Holz durch hitzebedingte chemische Zersetzung (Pyrolyse) zum Teil in gasförmige Stoffe, die aus dem Holz austreten und in einer Flamme verbrennnen. Die zurückbleibende Holzkohle (Gemisch aus Kohlenstoff und Asche) verglüht anschließend. Mengenverhältnis und SauerstoffbedarfSelbst bei einer hohen Brandstoffkonzentration muss es nicht zwangsläufig zu einer Verbrennung kommen. Ein Stoff brennt nur innerhalb bestimmter Grenzen, die durch das Verhältnis zwischen Brandstoff und Sauerstoff gesetzt sind. Liegt die Brandstoffkonzentration darunter, ist das Gemisch zu mager, liegt sie darüber, ist das Gemisch zu fett zum Zünden. Diese Werte lassen sich zum Teil berechnen: LuftzahlFür die Verbrennung an Luft wird die sogenannte Luftzahl benötigt. Diese ist ein Verhältniswert aus den Anteilen der Umgebungsluft, hauptsächlich also Sauerstoff und Stickstoff:
SauerstoffbedarfBezogen auf 1 mol Brennstoff erhält man den zur vollständigen Verbrennung erforderlichen Anteil Sauerstoff νO2 über:
Löst man obige Gleichung nach νO2 auf, so erhält man:
stöchiometrische KonzentrationenDie für die vollständige Verbrennung rechnerisch nötige Konzentration von Brennstoff erhält man über
Daraus lässt sich ebenso eine Explosionsgefährdung ablesen.
Die untere Explosionsgrenze lässt sich näherungsweise mit
BeispielAls Beispiel ist hier die vollständige Verbrennung von Propanol (C3H8O) genannt:
Somit sind zur vollständigen Verbrennung von 1mol Propanol 4,5 mol Sauerstoff nötig. Weiterhin lässt sich die stöchiometrische Konzentration, die für die Verbrennung nötig ist, berechnen:
Die untere Explosionsgrenze von Propanol lässt sich somit auf cex,u = 2,23 Vol% beziehungsweise cex,u = 115 g/m3 abschätzen. VerbrennungsgeschwindigkeitBeim brennbaren Material kann es nur zur Oxidation kommen, wenn ein einzelnes Atom oder Molekül des Brennstoffs mit Sauerstoff in direkten Kontakt kommt. Daher sind für die Verbrennungsgeschwindigkeit (Abbrandgeschwindigkeit) die Verfügbarkeit von Sauerstoff und sein inniger Kontakt mit dem Brennmaterial maßgeblich. Die Versorgung mit Sauerstoff kann man durch stete Zufuhr von Frischluft erreichen, indem man z. B. in ein Holzfeuer bläst. Für Holzfeuer ist der Kamin dabei ein ideales Hilfsmittel. In dem sich verengenden Kaminrohr steigen die erwärmten Abgase schnell auf und erzeugen einen steten Unterdruck um das Feuer. Dieser saugt permanent frische Luft heran. Eine extreme Ausprägung sind der Feuersturm bzw. Waldbrände, die durch Winde, z. B. den Mistral, angefacht werden. Die meisten Löschverfahren beruhen darauf, die Sauerstoffzufuhr zu unterbrechen (Löschdecke, Schaum, CO2-Löschanlage...). Um den innigen Kontakt herzustellen, muss man die Oberfläche des Brennstoffs vergrößern. Ideal ist es dabei, den Brennstoff in ein Gas zu verwandeln. Das geschieht bei der Kerze: Am Boden des Dochts schmilzt Wachs, steigt dann als Flüssigkeit auf und verdampft an der heißen Spitze. Das verdampfte Wachs verbrennt schließlich. Ein weiteres anschauliches Beispiel ist die Mehlstaubexplosion: Wird etwas Mehl in eine Kerzenflamme geblasen, wird das ansonsten unbrennbare Mehl durch die Zerstäubung brennbar und reagiert heftig. Beim Ottomotor und Dieselmotor erfolgt ebenfalls eine Verdampfung bzw. Zerstäubung. Flüssiger Dieselkraftstoff ist bei Raumtemperatur unbrennbar. Erst durch Zerstäubung in einer Einspritzanlage wird er brennbar. Über Benzin steht bei Raumtemperatur immer eine Benzindampfwolke. Daher ist Benzin leicht entzündlich. In einigen chemischen Verbindungen sind das »Oxidationsmittel« (Sauerstoff) und das zu oxidierende »Material« in demselben Molekül untergebracht, so z. B. in vielen Sprengstoffen. Das »Nitroglyzerin« mit der Summenformel C3H5N3O9 enthält pro Molekül 9 Sauerstoffatome (in drei Nitrat- bzw. Salpetersäure-Estergruppen) und damit mehr als genug, um die im Molekül enthaltenen Kohlen- und Wasserstoffatome vollständig zu Kohlendioxid und Wasser zu oxidieren. Die instabile Verbindung zerfällt explosionsartig schon bei leichten Erschütterungen; die gasförmigen Oxidationsprodukte bilden blitzartig ein Vielfaches des ursprünglichen Volumens und dadurch extrem hohen Druck, worauf die Wirkung dieses Sprengstoffs und aller anderen beruht. Auch die Treibsätze von Feststoffraketen bringen den Sauerstoff selbst mit, weil es ihn im Vakuum des Weltalls nicht gibt. LiteraturJ. Warnatz, U. Maas, R. W. Dibble, Verbrennung, 3.Aufl., Springer, ISBN 3-540-42128-9, (2001) |
|
| Dieser Artikel basiert auf dem Artikel Verbrennung_(Chemie) aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |




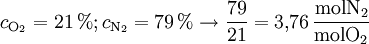
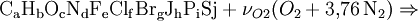
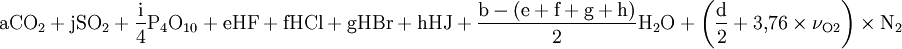
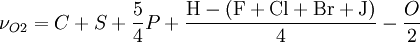 beziehungsweise
beziehungsweise
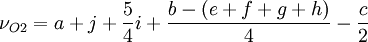 , wobei die Kleinbuchstaben die Anzahl der im Brandstoff enthaltenen Elemente angeben.
, wobei die Kleinbuchstaben die Anzahl der im Brandstoff enthaltenen Elemente angeben.
![\mathrm {c_{stoech}={100 \over 1+(1+3{,}76)\times\nu_{O 2}}\,[Vol%]}](images/math/9/2/e/92eed2bded45e0c9663be975eae37d06.png) beziehungsweise
beziehungsweise
![\mathrm {c_{stoech}={Vol% \times 124\times10^{-2} \over (0{,}02405)}}\,[g/m^3]](images/math/4/a/2/4a2bbb499c0b86bd77f4256fb3b9051d.png)
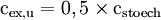 berechnen
berechnen
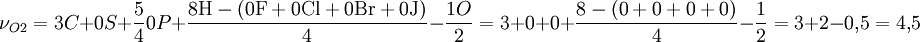
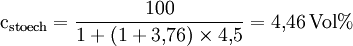 beziehungsweise
beziehungsweise