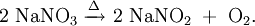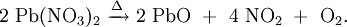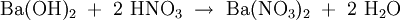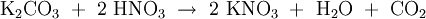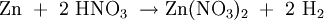Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
NitrateNitrate sind die Salze und Ester der Salpetersäure (HNO3). Die Salze haben die allgemeine Zusammensetzung MINO3 (MI: einwertiges Kation). Einige der Salze werden mit dem historischen Trivialnamen Salpeter bezeichnet. Das planare Anion NO3- trägt eine negative Ladung. Die Ester der Salpetersäure werden auch Salpetersäureester genannt und haben die allgemeine Struktur R–O–NO2 (R: organischer Rest). Einige Salpetersäureester werden fälschlicherweise als Nitroverbindung bezeichnet, so z. B. Glycerintrinitrat als Nitroglyzerin. Nitroverbindungen (R-NO2) haben jedoch im Gegensatz zu Nitraten eine C-N-Bindung. Produkt-Highlight
Beispiele
StrukturDas Nitrat-Ion ist planar gebaut. Alle Bindungswinkel O–N–O betragen 120°. Ebenso sind die Bindungslängen der N–O-Bindungen gleich lang und liegen zwischen den Längen für Einfach- bzw. Doppelbindungen. Die reale Struktur des Nitrat-Ions muss deshalb zwischen drei mesomeren Grenzstrukturen existieren: Stickstoff verfügt als Element der zweiten Periode über keine Oktettaufweitung durch d-Orbitale, so dass die auf den ersten Blick ungünstig erscheinenden mesomeren Grenzstrukturen mit positiven und negativen Ladungen vorliegen. EigenschaftenDie Salze sind gut löslich in Wasser und spielen eine wichtige Rolle als Nährstoff für Pflanzen. Nitratanionen selbst sind weitgehend ungiftig. Grenzen zur Toxizität für Säugetiere und Menschen liegen in der gleichen Größenordnung wie diejenigen von Chloriden und Sulfaten, nämlich im zweistelligen Grammbereich. Große Mengen führen jedoch — wie bei allen Salzen — zu osmotischen Problemen (siehe: Osmoregulation). Als Lebensmittelzusatzstoffe werden Nitrate im Milligrammbereich verwendet. Beim trockenen Erhitzen (Schmelzen) zerfallen Nitrate. So reagiert Natriumnitrat unter Sauerstoffabspaltung zu Natriumnitrit:
Alkalinitrate werden als Oxidationsmittel z. B. im Schwarzpulver verwendet. HerstellungNitratsalze sind durch Umsetzung von Salpetersäure beispielsweise mit Hydroxiden, Carbonaten, Metallen o. ä. leicht zugänglich:
Nitrate sind auch durch vollständige Oxidation von Stickstoffverbindungen wie Nitriten, Ammoniak oder Hydroxylamin zugänglich. VorkommenNitrate sind in der Biosphäre / Hydrosphäre allgegenwärtig. Abbauwürdige Mengen von Nitraten finden sich hauptsächlich in Form von Natriumnitrat. Der Hauptfundort dieses Salzes ist Chile, daher auch der Trivialname Chilesalpeter. Weitere natürliche Vorkommen gibt es in Ägypten, Kleinasien, Kolumbien und Kalifornien. Nitrate der häufigen Alkali- und Erdalkalimetalle kommen in natürlicher Form als Chile-, Kalk- oder Kalisalpeter vor. Bildung und Abbau von NitratenIm Boden und in Gewässern werden Nitrate durch bakterielle Nitrifikation gebildet. Als Endprodukt dieses Prozesses entstehen sie durch Zersetzung insbesondere eiweißhaltiger Stoffe. Die Oxidation durch Bakterien der Gattung Nitrosomonas führen von Ammoniak zu Nitriten, welche durch Bakterien der Gattung Nitrobakter zum Nitraten oxidiert werden. Beim Mangel an Sauerstoff führt hingegen die bakterielle Denitrifikation zu elementarem Stickstoff. Nitrate in TrinkwasserDer aktuelle Grenzwert für NO3− in Trinkwasser liegt laut der deutschen Trinkwasserverordnung bei 50 mg/l, nach der schweizerischen Gewässerschutzverordnung bei 25 mg/l [1]. Wässer, die diesen Grenzwert überschreiten, werden von Wasserversorgern oft mit nitratärmerem Wasser vermischt, um den Grenzwert einzuhalten. VerwendungNitrate werden von Pflanzen als Nährstoffe verwertet und in der Landwirtschaft als Düngemittel eingesetzt. Als Lebensmittelzusatzstoff wird Natriumnitrat (E 251) und Kaliumnitrat (E 252) als Konservierungsmittel z. B. zum Pökeln von Fleisch- und Wurstwaren verwendet. Kaliumnitrat ist Bestandteil des Schwarzpulvers (Sprengsalpeter). Es werden gegebenenfalls auch andere Nitrate ersetzt, wenn farbige Lichteffekte in der Pyrotechnik gewünscht werden. DüngungNitrate können direkt von pflanzlichen Organismen als Stickstoffquelle aufgenommen und verwertet werden. In der Landwirtschaft werden Nitrate als Dünger, auch in Form von Gülle (allg. Wirtschaftsdünger) eingesetzt. Eine überzogene Düngung führt zu Eutrophierung u. a. vom Ökosystem See. Besonders bei Gewässern mit geringer Fließgeschwindigkeit kann im Zusammenwirken mit Phosphorverbindungen ein vermehrtes Algenwachstum beobachtet werden. Bei übermäßigem Eintrag verschiebt sich der Nährstoffhaushalt oligotropher Standorte (Böden, Gewässer) zugunsten eutropher Bedingungen. Eine weitere Folge ist ein Anstieg des Nitratgehaltes in Grund- und Trinkwasser. Gesundheitliche BedeutungDie Ursache für gesundheitliche Risiken liegt in der Gefahr einer Reduktion des Nitrats zu Nitrit und die Bildung von krebserregenden Nitrosaminen. Diese ist gegeben, wenn der Darm durch entsprechende Bakterien besiedelt ist, die eine solche Reduktion durchführen können. Die Erstlingsflora des Darmes bei Säuglingen kann auch nitritbildende Bakterien enthalten, die in einer Verbindung mit Hämoglobin zu Methämoglobinämie führen können, sodass der Säugling von innen erstickt. Auch bei Wiederkäuern besteht durch Nitratreduktion im Pansen eine akute Gefahr der Nitritbildung. Hier werden sogar Nitratkonzentrationen in Trinkwasser über 20 mg/l als schädlich betrachtet. SalpetersäureesterOrganische Nitrate – die Salpetersäureester – sind häufig Verbindungen, die sich explosionsartig zersetzen können. Daher finden einige von ihnen als Explosivstoffe Verwendung (z. B. Nitropenta oder Glycerintrinitrat). Zellulosenitrat mit unterschiedlichen Nitrierungsgraden findet Verwendung in der Pyrotechnik, ist ein Bestandteil in Nitrozelluloselacken (Nitrolacke) und in Zelluloid. SyntheseEster der Salpetersäure werden durch Veresterung eines Alkohols mit Salpetersäure erhalten. Zur Nitrierung kann ein Gemisch aus konzentrierter Salpetersäure und konzentrierter Schwefelsäure, der so genannten Nitriersäure, eingesetzt werden. In der Nitriersäure bildet sich das Nitryl-Kation NO2+:
Nachweise
Literatur
Quellen
Kategorien: Stoffgruppe | Nitrat |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Nitrate aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||