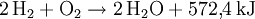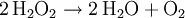Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
WasserstoffoxideWasserstoffoxide (auch Hydrogeniumoxide) sind Verbindungen, die nur aus Wasserstoff (H) und Sauerstoff (O) bestehen. Produkt-HighlightFolgende Verbindungen sind von technischer Bedeutung:
WasserMolekularer Wasserstoff H2 reagiert mit molekularem Sauerstoff O2 exotherm zu Wasser (H2O) und zwar im Stoffmengenverhältnis zwei Mol H2 zu 1 Mol O2:
Bei dieser sogenannten Knallgasreaktion wird Energie frei. Pro Mol Wasser sind das die in der Gleichung angegebenen 572,4 kJ. Werden die beiden einfachen Wasserstoffatome (Protium 1H) durch doppelt so schwere Deuteriumatome ersetzt, so erhält man schweres Wasser (D2O). Hat lediglich eines der beiden H-Atome einen Deuteriumkern, spricht man korrekterweise von halbschwerem Wasser (HDO); oft ist aber ebenfalls die Bezeichnung schweres Wasser üblich. Handelt es sich nicht um Deuterium, sondern um Tritium, spricht man von überschwerem Wasser. Diese beiden Formen des Wassers haben leicht unterschiedliche physikalische Eigenschaften. Zum Beispiel liegt der Schmelzpunkt bei 3,82 °C und der Siedepunkt bei 101,42 °C für schweres Wasser, respektive bei 4,48 °C und 101,51 °C für überschweres Wasser. Die chemischen Eigenschaften sind weitgehend wie die von gewöhnlichem Wasser, diese beiden Formen sind lediglich etwas reaktionsträger. Wasser spielt wohl die wichtigste Rolle für die Funktions- und Lebensfähigkeit von Organismen. In der unbelebten Geosphäre ist es ein wichtiges Medium bei geologischen und ökologischen Elementarprozessen. Durch die Rolle des Wassers in Bezug auf Wetter und Klima, als Landschaftsgestalter im Zuge der Erosion und durch seine wirtschaftliche Bedeutung unter anderem in den Bereichen der Land-, Forst- und Energiewirtschaft ist es zudem in vielfältiger Weise mit Geschichte, Wirtschaft und Kultur der menschlichen Zivilisation verbunden. Die Wissenschaft, welche sich mit der räumlichen wie zeitlichen Verteilung des Wassers und dessen Eigenschaften beschäftigt, bezeichnet man als Hydrologie. WasserstoffperoxidWasserstoffperoxid ist eine instabile Verbindung aus jeweils zwei Wasserstoff- und Sauerstoffatomen (H2O2). Die Verbindung kann spontan zu Wasser und Sauerstoff zerfallen:
H2O2 ist sehr reaktiv und wird deshalb mit stabilisierenden Stoffen versetzt. Es ist ein beliebtes Oxidationsmittel, da als Nebenprodukt nur Wasser entsteht. Weitere OxideEin weiteres, aber selteneres Oxid ist das Dihydrogentrioxid (H2O3). Die Verbindung ist noch instabiler als H2O2 und zerfällt bereits bei einer Temperatur von -40 °C. Dihydrogentrioxid hat kaum technische Verwendungsmöglichkeiten und ist eher von theoretischem Interesse. Besondere Bedeutung für den pH-Wert haben die Oxonium-Ionen H3O+ (auch Hydronium-Ionen genannt). Es handelt sich gewissermaßen um eine um ein Proton „erweiterte“ Form des Wassers. Sie bilden sich automatisch in Wasser (Autoprotolyse), vor allem aber bei Zugabe von Säure. Diese Ionen sind äußerst instabil und bestehen nur für Pikosekunden, bevor sie das dritte Proton an ein anderes Wassermolekül abgeben. Die Hydroxidionen OH- sind sozusagen die Gegenspieler der H3O+-Ionen. Sie entstehen vorrangig bei Anwesenheit von basischen Verbindungen, aber ebenfalls auch bei der Autoprotolyse. Die Konzentration von OH- und H3O+ bestimmt den pH-Wert. Kategorien: Wasserstoffverbindung | Sauerstoffverbindung |
| Dieser Artikel basiert auf dem Artikel Wasserstoffoxide aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |