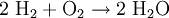Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
KnallgasKnallgas ist eine explosionsfähige Mischung von gasförmigen Wasserstoff und Sauerstoff. Beim Kontakt mit offenem Feuer (Glut oder Funken) erfolgt die so genannte Knallgasreaktion. In Luft unter atmosphärischem Druck muss der Volumenanteil des Wasserstoffs dabei zwischen 4 und 77 % liegen. Werden diese Grenzwerte unter- bzw. überschritten, kommt es nicht mehr zu einer Explosion. Bei einer kontrollierten Verbrennung kommt es zu einer Knallgasflamme. Die größte Reaktion entsteht bei einem Verhältnis von Zwei Wasserstoff Und 1 Sauerstoff. Sollte der Sauerstoff aus der Luft genommen werden, führt ein Volumenverhältnis von etwa 2:5 zu einer besonders großen Explosion. Produkt-HighlightKnallgasreaktionDie Knallgasreaktion ist die explosionsartige (exotherme) Reaktion von Wasserstoff mit Sauerstoff. Sie ist eine Form der Verbrennung (Oxidation). Die Reaktionsgleichung lautet:
Es handelt sich um eine stark verzweigte Kettenreaktion (Kettenverzweigungsexplosion) unter Beteiligung von Wasserstoff-, Sauerstoff- und Hydroxyl-Radikalen als Kettenträger. H2 → H + H (Kettenstart) Das Reaktionsprodukt ist Wasser. Die pro molaren Formelumsatz freiwerdende Energie beträgt ΔrH0 = -571,6 kJ/mol. Damit ändert sich die Enthalpie H für ein Mol des entstehenden Wassers um -286 kJ/mol. Als Nebenreaktion entsteht auch Wasserstoffperoxid gemäß:
In den Mitochondrien lebender Zellen kommt es bei der Endoxidation im Komplex IV in der Atmungskette zu einer analogen, aber strikt kontrollierten exergonen Reaktion (biologische Knallgasreaktion), die der Energiegewinnung der Zelle, d.h. der Bildung von ATP-Molekülen dient:
Die freie Enthalpie ΔG°' der Reaktion ergibt sich aus ihrem Redoxpotential (+0,5 V) und beträgt bei physiologischen Bedingungen (pH 7) -193 kJ/mol. Die gleiche Reaktion findet auch in der Brennstoffzelle statt. Bei der Konstruktion von Brennstoffzellen wird versucht, die bei der Knallgasreaktion frei werdende Energie (Enthalpiedifferenz) hier genauer: freie Enthalpie oder Gibbs-Energie ΔG zu nutzen, ohne eine Explosion herbeizuführen. Die dabei frei werdende Enthalpie wird zum Teil als elektrischer Strom und zum Teil als Wärme freigesetzt. Die Reaktion läuft in der Brennstoffzelle jedoch langsam und kontrolliert ab. Knallgas lässt sich durch die elektrolytische Zersetzung von Wasser herstellen, z. B. indem man Strom durch eine verdünnte Säure oder Lauge leitet, oder auch durch thermische Zersetzung von Wasser. Aus Batterien tritt ständig eine kleine Menge Knallgas aus. Werden viele Batterien in einem Raum gelagert (etwa in Werkstätten), dann kann die Konzentration des Gases gesundheitsschädigend und hoch explosiv sein. Daher müssen solche Räume unter ständiger Kontrolle der Knallgaskonzentration stehen. Bekannte Knallgasexplosionen sind die Explosion des Reaktorkerns bei der Katastrophe von Tschernobyl und der Fehlstart der Challenger-Raumfähre. KnallgasprobeMit dem Begriff Knallgasprobe bezeichnet man in der Chemie einen Nachweis von Wasserstoff. Für den Nachweis wird üblicherweise das zu überprüfende Gas in einem Reagenzglas mit der Öffnung nach unten (damit Wasserstoff wegen der geringeren Dichte als Luft nicht entweichen kann) an eine Zündquelle (Bunsenbrenner, Feuerzeug) gehalten. Fall 1: Das aufgefangene Gas ist reiner Wasserstoff. Es kommt zu einer ruhigen Verbrennung oder eventuell schwachen Verpuffung (negative Knallgasprobe). Fall 2: Das aufgefangene Gas ist ein Gemisch aus Wasserstoff und Sauerstoff (Knallgas). Die Verbrennung erfolgt mit einem pfeifenden Geräusch (positive Knallgasprobe). Aufgrund der unterschiedlichen Geräusche bei reinem Wasserstoff und dem Gemisch Wasserstoff mit Sauerstoff wird die Knallgasprobe auch zur Überprüfung der Reinheit einer Wasserstoff-Atmosphäre verwendet, um eine Explosion in einem geschlossenen Gefäß zu vermeiden. Ähnlich wie Knallgas explodiert das Chlorknallgas. Literatur
Kategorien: Stoffgemisch | Gas | Chemisches Analyseverfahren | Wasserstoffchemie |
| Dieser Artikel basiert auf dem Artikel Knallgas aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |