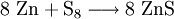Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Zinksulfid
Zinksulfid (genauer Zink(II)-sulfid; Summenformel ZnS) ist das Zink-Salz der Schwefelwasserstoffsäure. Es kommt in der Natur mineralisch als kubischer Sphalerit (Zinkblende) und hexagonaler Wurtzit vor und kann bergmännisch abgebaut werden. Sowohl in Sphalerit als auch im Wurtzit sind die Zink-Ionen tetraedrisch von vier Sulfid-Ionen umgeben und umgekehrt. Beide Kristallstrukturen sind Prototypen für eine ganze Reihe von Verbindungen. Wurtzit stellt die Hochtemperatur-Modifikation dar. Zinksulfid ist ein II-VI-Verbindungshalbleiter (EG= 3,54 eV, bei Raumtemperatur). Produkt-HighlightDarstellungZinksulfid kann durch Oxidation von Zink mit Schwefel hergestellt werden: Es entsteht auch bei der Umsetzung wässriger Lösungen von Zinksalzen mit Ammoniumsulfid-Lösung als weißer bis schwach gelber amorpher Niederschlag. VerwendungMit Al3+- und Cu+-Ionen dotiertes Zinksulfid zeigt Lumineszenz und wird für Leuchtschirme und nachleuchtende Zifferblätter von Uhren verwendet. Ebenso kommt es in Elektrolumineszenz-Folien zur Anwendung. In der Malerei wird es zusammen mit Bariumsulfat als Weißpigment genutzt (s. Lithopone). Nachteilig für die Anwendung als Pigment ist die eingeschränkte Beständigkeit von ZnS speziell bei Außenanwendungen. Sauerstoff oxidiert ZnS langsam zu löslichem Zinksulfat. Quellen
Kategorien: Zinkverbindung | Sulfid |
||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Zinksulfid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||