Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
KomplexbildungsreaktionEine Komplexbildungsreaktion ist eine chemische Reaktion (Stoffumwandlung), bei der ein Metall-Kation mit Molekülen oder Ionen reagiert, die als Lewis-Basen ihre freien Elektronenpaare zur Bildung einer koordinativen Bindung mit dem Kation zur Verfügung stellen (vgl. Ligand, Komplexchemie). Komplexbildungsreaktionen sind oft durch Farbumschläge gekennzeichnet. In der Summenformel sowie im Reaktionsschema wird der Komplex durch eckige Klammern angedeutet, in denen vorne das Zentralatom wie z.B. ein Kupferkation und in runden Innenklammen die Liganden stehen (Beispiel: [Cu(NH3)4]2+). Weiteres empfehlenswertes Fachwissen
Beispiele für KomplexbildungsreaktionenBildung des Tetraaquakupfer-KomplexesWasserfreies, weißes Kupfersulfat färbt sich bei Zugabe von Wasser hellblau - eine Nachweisreaktion für Wasser. Es entsteht ein Aqua-Komplex des Kupfers, bei dem vier Wassermoleküle als Liganden des Zentralions auftreten: Bildung des Tetramminkupfer-KomplexesKupfer-II-salze ergeben auch mit Ammoniaklösung bei pH-Werten über 8 tiefblaue Komplexsalz-Lösungen (Kupfertetramminkomplex [Cu(NH3)4]2+ - auch als Tetramminkupfer(II) bezeichnet, vgl. Abbildung dieser Nachweisreaktion): Der Kupfertetrammin-Komplex ist wie der Kupfertetraquokomplex zweifach positiv geladen, da sich 4 neutrale Moleküle an das Zentralatom binden. Wenn sich jedoch Anionen wie z.B. Chlorid-Anionen an das Zentralatom binden, so kann der Komplex auch negativ geladen sein (z.B. ist der grüne Tetrachlorocuprat-II-Komplex zweifach negativ geladen): Anionische Komplexe werden andersartig benannt (Metall-Name mit Endung -at am Namensende) und sind von großer Bedeutung auch in der Biochemie. Bildung des Nickel-Dimethylglyoxim-Komplexes
Nickelsalzlösung bildet mit einer alkoholischen Dimethylglyoxim-Lösung (DMG) Komplexe. In ammoniakalischer Lösung fällt das himbeerrote Nickel-dimethylglyoxim als Komplex aus: Dieser Komplex ist im Unterschied zum Kupfertetrammin- oder Kupfertetraquo-Komplex neutral und in Wasser unlöslich. Komplexbildung als GleichgewichtDerlei Lewis-Säure-Base-Reaktionen zur Komplexbildung sind Gleichgewichtsreaktionen, für die das Massenwirkungsgesetz aufgestellt werden kann. Die resultierende Gleichgewichts-Konstante nennt man Komplexbildungskonstante. Sie gibt auch an wie stabil der Komplex ist bzw. ob er zur Dissoziation neigt. Ihr reziproker Wert wird als Komplexdissoziationskonstante KD bezeichnet, also KA-1 = KD. Einordnung und Bedeutung von Komplexbildungsreaktionen
Neben der Komplexbildungsreaktion gibt es in der Komplexchemie also auch Ligandenaustausch- und Dissoziationsreaktionen, bei denen Komplexe erzeugt oder wieder abgebaut werden. Viele Komplexbildungsreaktionen sind in Bereichen wie der Katalyse, der Biochemie, der Farbstoffchemie, der Analytischen Chemie mit ihren Nachweisreaktionen insbes. für Kationen im Kationentrenngang sowie der Chemischen Technologie von großer Bedeutung. Viele farbige Komplexe dienen ferner der Erforschung von Atom- und Molekülstrukturen (so z.B. der Chrom-Hexammin-Komplex, Abbildung, oder die neuartigen Sandwichkomplexe), von Stoffwechselvorgängen (Hämoglobin bei der Atmung, Chlorophyll bei der Photosynthese,Komplexe mit Eisensulfid-Mineralien bei der chemischen Evolution und der Entstehung des Lebens ("Eisen-Schwefel-Welt", vgl. unter chemische Evolution) , viele Enzyme, einige Vitamine), Licht-Materie-Wechselwirkungen (Pigmente und Farbstoffe) und von katalytischen Vorgängen. |
|
| Dieser Artikel basiert auf dem Artikel Komplexbildungsreaktion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





![\mathrm{CuSO_4 + 4 \ H_2O \longrightarrow [Cu(H_2O)_4]^{2+} + SO_4^{2-}}](images/math/d/3/0/d3004cd04fd473739a5b9aacc8980537.png)
![\mathrm{Cu^{2+} + 4 \ NH_3 \longrightarrow [Cu(NH_3)_4]^{2+}}](images/math/8/a/c/8ac1bf28d69ab033192aab2bd2029cca.png)
![\mathrm{Cu^{2+} + 4 \ Cl^- \longrightarrow [Cu(Cl)_4]^{2-}}](images/math/1/f/c/1fce8054ede33e3a7d5440e397ddfd3f.png)
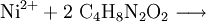
![\mathrm{H_2[Ni(C_4H_6N_2O_2)_2] + 2 \ H^+}](images/math/1/3/1/1311c15d2ba9391b13d67582b04387fb.png)


