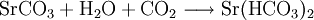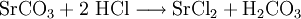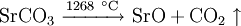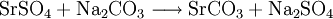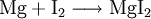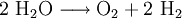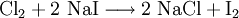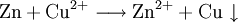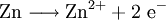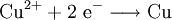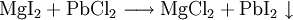Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ReaktionsschemaEin Reaktionsschema ist in der Chemie die symbolische Wiedergabe einer Stoffumwandlung (=chemische Reaktion) in Form von Formeln und stöchiometrischen Koeffizienten sowie einem Reaktionspfeil ( Der Artikel Reaktionsgleichung beschreibt diesen Grundbegriff der Chemie und ihrer Formelsprache fachwissenschaftlich näher, während hier im Folgenden die Regeln erläutert werden, nach denen in der Formelsprache der Chemie ein solches Reaktionsschema (eine solche Reaktions- bzw. chemische Gleichung) formal korrekt erstellt wird. Es handelt sich dabei um ein zumeist als theoretisch und trocken empfundenes Themengebiet in der Chemie (ihr „kleines Einmaleins“), weshalb hier versucht wird, das Erstellen und die Regeln von Reaktionsschemen möglichst einfach und auch für Laien verständlich zu erläutern. Produkt-Highlight
Grundsätzlicher Aufbau eines ReaktionsschemasIn einem Reaktionsschema finden sich links vom Reaktionspfeil die Ausgangsstoffe und rechts davon die Endstoffe der Stoffumwandlung. Die beteiligten Stoffe werden dabei in Form ihrer chemisch-systematischen Namen, international jedoch als Summenformeln oder als Strukturformeln wiedergegeben. Beispiel: Ein Gemisch aus Eisen- und Schwefelpulver reagiert nach Zündung im Stoffmengen-Verhältnis 1:1 zu Eisen(II)-sulfid (Es gibt auch ein Eisensulfidmineral Pyrit, das soll hier jedoch unberücksichtigt bleiben). In Worten lautet das Reaktionsschema:
Wenn man die Symbole der Elemente verwendet, lautet es:
Bestandteile und Symbole im ReaktionsschemaZusätzlich zum Reaktionspfeil und zu den Symbolen der beteiligten Stoffe finden sich in einem Reaktionsschema in Formelschreibweise großgeschriebene Zahlen zur Wiedergabe von Stoffmengen-Verhältnissen (stöchiometrische Faktoren, Koeffizienten) sowie etwaige Angaben über die Aggregatzustände der beteiligten Stoffe (z. B. (g) für gasförmig, (l) für flüssig (lat.: liquidus), (s) für fest (lat.: solidus) oder (aq) für in wässriger Lösung) oder elektrische Ladungen der Teilchen (Ionen). Ein Pfeil nach oben hinter einer Formel zeigt bei Bedarf noch das Entweichen eines Gases aus einer Flüssigkeit oder einem Feststoff an ( Der Reaktionspfeil als Bestandteil des ReaktionsschemasDer Reaktionspfeil symbolisiert die chemische Reaktion. Er wird als Formeln als Bestandteile von Reaktionsschemen
Die Ausgangs- und Endstoffe der Reaktion (Edukte und Produkte) werden in Form von Stoffnamen oder chemischen Formeln in das Reaktionsschema eingebaut. In der Regel werden hier Summenformeln benutzt, die sich aus den Symbolen der beteiligten Elemente bzw. Atomsorten und kleinen tiefgestellten Zahlen zusammensetzen. Letztere geben die Verhältnisse der Atomanzahlen bzw. Stoffmengen n der Elemente in ihren jeweiligen Verbindungen wieder:
Reaktionsschemen lesenBeide Seiten des Schemas werden durch einen Reaktionspfeil getrennt. An ihm sieht man, ob die Reaktion vollständig abläuft oder ob sie umkehrbar und somit eine Gleichgewichtsreaktion ist: Wenn sie nicht umkehrbar ist, ist es der nach rechts zeigende Pfeil, wobei links die Ausgangsstoffe (Edukte) stehen, rechts die Endstoffe (Produkte). Bei Gleichgewichtsreaktionen ist es der Doppelpfeil oder Gleichgewichtspfeil. Wenn Eisenpulver mit Schwefelsäure reagiert, löst es sich unter Gasentwicklung auf. Das Salz Eisensulfat kristallisiert danach aus dem Filtrat bei Verdunstung oder Einengung durch Verdampfen (Abbildung). Das Schema dieser Reaktion lautet z. B.:
Auch das Reaktionsschema zeigt eine normalerweise nicht umkehrbare Reaktion an: Natrium (Formel: Na) und Sauerstoff (Formel: O2, da Sauerstoffatome im Gas paarweise miteinander verbunden als Moleküle vorkommen) werden bei der Verbrennung des Alkalimetalles Natrium im Atomanzahlen-Verhältnis n(Na) : n(O) = 2 : 1 und zu 100 % in eine Verbindung namens Natriumoxid eingebaut: Na2O. Das geschieht jedoch nur, wenn die reagierenden Stoffe (Reaktanden) genau im Stoffmengen-Verhältnis n(Na) : n(O2) = 4 : 1 vorliegen – ansonsten bleibt ein Rest unverbrauchten Ausgangsstoffes unverändert zurück. Eine chemische Gleichung besagt also nicht, dass ALLE Reagentien vollkommen verbraucht werden. Zudem existieren unterschiedliche Schreibweisen: Eine Ionengleichung ist von den Ladungen her ausgeglichen – in einer Gleichung in Vollschreibweise werden alle Reaktanden als Summenformeln geschrieben. Vor den Summenformeln stehen, wie gesagt, die stöchiometrischen Faktoren: Der Ausdruck 2 H2O + 3 CH4 in einem Reaktionsschema besagt also zum Beispiel: Je 2 Wassermoleküle H2O entsprechen oder reagieren mit je 3 Molekülen Methangas CH4. Arten chemischer ReaktionenDie vier grundlegenden Möglichkeiten einer Stoffumwandlung (chemische Reaktionen) sind:
Die Symbole A, B, C, D sowie AB und BC stehen in Form von chemischen Formeln (Summenformeln, Strukturformeln) für die Stoffe, die bei dieser Reaktion umgesetzt werden, der Reaktionspfeil Beispiele für derlei Arten chemischer Reaktionen, deren gebräuchliche Bezeichnungen und Reaktionsschemen dazu sind:
Reaktionsschemen erstellen1) Wenn zwei Stoffe sich 1:1 vereinigen, so genügt es, im Reaktionsschema die Elementsymbole der Ausgangs- und Endstoffe sowie deren Formeln aufzuzählen. Das Reaktionsschema für die Synthese von Kupfer(II)-sulfid aus den Elementen lautet dem Reaktionstyp
2) Bei einer Vereinigung im Atomzahl- bzw. Stoffmengenverhältnis 2:1 ergäbe sich: Die große 2 links zeigt an, dass je 2 Kupfer-Atome Cu mit je einem Schwefelatom S reagieren, die kleine 2 rechts in der Formel zeigt an, dass im Kupfer(I)-sulfid nun je zwei Atome Cu mit je einem Schwefelatom fest vereinigt sind. 3) Die Gleichgewichtsreaktion zur Herstellung von Ammoniakgas aus den Gasen Stickstoff und Wasserstoff nach dem Haber-Bosch-Verfahren formuliert man aufgrund des Stoffmengen-Verhältnisses n(N) : n(H) = 1 : 3 als:
Hier ist die Besonderheit, dass bei den gasförmigen Ausgangsstoffen die Atome paarweise zu Molekülen verbunden sind: Die tiefgestellten,kleinen Ziffern 2 sind Bestandteil der Formel – die große 2 rechts sowie die 3 links ein stöchiometrischer Faktor. Die chemische Gleichung muss also die Stoffmengen- bzw. Molzahlen-Verhältnisse, also die Stöchiometrie der Reaktion wiedergeben, sie muss ausgeglichen sein (s. u.)! 4) Die Verbrennung von Methan (Formel: CH4) in Sauerstoffgas (Formel: O2) zu Kohlendioxid (CO2) und Wasserdampf (H2O) wird z. B. folgendermaßen formuliert: Hier musste also durch Verdoppelung der Sauerstoff- und Wasserstoffmengen ausgeglichen werden. 5) Wenn elektrisch geladene Teilchen entstehen (Ionen), gibt man deren Ladungen in Form hochgestellter,kleiner Zahlen mit an. So kann z. B. ein sehr geringer Anteil der Wassermoleküle in Hydronium- (H3O+) und Hydroxid-Ionen (OH−) zerfallen (Dissoziation, Autoprotolyse). Das würde man folgendermaßen beschreiben: Auch hier ist auszugleichen: Es sind jeweils zwei Wassermoleküle als Ausgangsstoffmengen erforderlich. Das Ausgleichen chemischer GleichungenIn einem Reaktionsschema müssen auf beiden Seiten des Reaktionspfeiles von jeder beteiligten Atomsorte gleichviel Teilchen stehen; das Erstellen eines Reaktionsschemas erfolgt daher in mehreren Schritten. So z. B. bei der Verbrennung von Natrium-Metall:
Ähnlich ginge man beim Erstellen des Schemas für die Verbrennung von Phosphor vor:
Sonderregeln für besondere ReaktionsartenBeispiele für RedoxreaktionenBei Redoxreaktionen werden elektrische Ladungen in Form von Elektronen ausgetauscht. In diesen Reaktionsschemen ist auf ausgeglichene Ladungsbilanzen, also die Anzahl der Ladungen bzw. Elektronen zu achten: Die Amalgamprobe als RedoxreaktionQuecksilbersalze reagieren mit weniger edlen Metallen wie z. B. Kupfer. Man weist sie daher durch die Amalgamprobe nach: Die salpetersaure Lösung wird auf ein Kupferblech gegeben – zurück bleibt ein nicht abwischbarer, silbriger Amalgamfleck: Im Reaktionsschema kann man die Ionenschreibweise verwenden und so auf das Mitanführen der nicht mitreagierenden Nitrat-Anionen verzichten. Die Verbrennung von Ethanol (Brennspiritus) als RedoxvorgangDie beim Entzünden von Brennspiritus ablaufende Reaktion wird schrittweise folgendermaßen formuliert: 1.) Die Formeln der beteiligten Stoffe werden eingesetzt:
2.) Das komplizierteste Molekül hier ist C2H5OH, so dass eine 2 vor CO2 gesetzt werden sollte, um die Zahl der C-Atome auszugleichen: 3.) Da C2H5OH 6 Wasserstoffatome enthält, ist zum Ausgleichen eine 3 zu schreiben (vor das H2O): 4.) Zum Schluss gleicht man die Sauerstoffatome aus (links 3, rechts 7), indem man eine 3 setzt (vor O2): Das Redoxpaar Iodid/Iodat in LaugenEin Stoff kann bei einer Redoxreaktion als Gleichgewichtsreaktion in reduzierter sowie in oxidierter Form vorliegen. Soetwas nennt man ein Redoxpaar. So ist das Reaktionsgemisch aus Iodid und Iodat ein solches Redoxsystem: I−/IO3− Dessen Gleichgewichtsreaktion in einer Base (Lauge, mit Hydroxidionen) formuliert man mit einem Doppelpfeil wie folgt:
denn: Es ergibt sich: und gekürzt: Das Ausgleichen über mathematische GleichungenBei schwierigeren Gleichungen kann mit Variablen gearbeitet werden. Das ist zum Beispiel beim Erstellen des Reaktionsschemas für die Zersetzung von Blutlaugensalz (Kaliumhexacyanoferrat) mit konzentrierter Schwefelsäure erforderlich: 1. Festlegung von Variablen für jeden Koeffizienten: 2. Auf jeder Seite der Gleichung müssen gleichviel Atome jeder Sorte stehen. Also sind diese auszuzählen: 3. Lösen der Gleichungen so hängen nun alle Koeffizienten von einem Parameter ab: a=1. 4. Die ausgeglichene Reaktionsgleichung lautet nun: Um den Vorgang zu beschleunigen empfiehlt sich ein Algorithmus: 1. Die chemischen Elemente identifizieren, die in den Verbindungen vorkommen 2. Eine Verbindung auswählen, in der hohe Koeffizienten auftauchen, und diesen z. B. als a bezeichnen: 3. Nun sollte K2SO4 2 a sein (wegen des Kaliums K), und FeSO4 1 a (wegen des Eisens Fe), CO 6 a (wegen C) und (NH4)2SO4 3 a (wegen N). Das erlaubt es, die ersten vier Gleichungen aus unserem System herauszukürzen! Die Verhältnisse können so gewahrt bleiben: 4. Die Gleichung kann nun formuliert werden; indem wir die S-Atome zufügen, erhalten wir 6 a für H2SO4 und indem wir die H-Atome hinzufügen (oder die O-Atome), erhalten wir 6 a für H2SO4. 5. Ergebnis wäre dann: Reaktionsgleichungen in (Übungs-)Beispielen mit Kupfer und seinen Verbindungen1.) Beim Erhitzen über etwa 800 °C wird Kupfer(II)-oxid unter Sauerstoffabgabe zu Kupfer(I)-oxid umgewandelt: 2.) Werden metallisches Kupfer und Kupfer(II)-oxid zusammen erhitzt entsteht ebenfalls Kupfer(I)-oxid: 3.) Kupfer(II)-sulfid wird (im Labor) durch Fällung aus wässriger Lösung dargestellt, beispielsweise durch Einleiten von Schwefelwasserstoff: Es kann auch durch direkte Reaktion von Schwefel mit Kupfer hergestellt werden: 4.) Kupfer(II)-oxid wird aus (frisch gefälltem) Kupfer(II)-hydroxid hergestellt: 5.) Kupfer(II)-hydroxid wird durch Laugen aus einer Cu(II)-Salzlösung ausgefällt: 6.) Kupfer wird in konzentrierter Salpetersäure gelöst: 7.) Das entstandene, farblose Stickstoffmonoxid reagiert sofort mit Luftsauerstoff zum rotbraunen Stickstoffdioxid weiter: 8.) Kupfer(II)-oxid wird bei erhöhter Temperatur durch verschiedene Reduktionsmittel (beispielsweise Kohlenstoff, Kohlenmonoxid,Wasserstoff) zu metallischem Kupfer reduziert: 9.) Beim Erhitzen von Kupfer(II)-oxid mit Chlorwasserstoff wird Kupfer(II)-chlorid gebildet: 10.) Kupfer(II)-oxid kann durch thermische Zersetzung (Pyrolyse) von Kupfer(II)-nitrat oder Kupfer(II)-carbonat dargestellt werden:
Reaktionssschemen zu verschiedenen Arten chemischer Reaktionen in weiteren Beispielen1.) Iodwasser ist die wässrige Lösung des Halogens Iod. Beim Lösen tritt folgende Gleichgewichtsreaktion auf:
2.) Strontiumcarbonat löst sich nicht in reinem, jedoch in Kohlendioxid/Kohlensäure-haltigem Wasser. Dabei bildet sich Strontiumhydrogencarbonat (Synthese): 3.) In Mineralsäuren entstehen aus Strontiumcarbonat lösliche Strontiumsalze. Man beobachtet dabei die Entstehung von Kohlensäure, die weiter zu Wasser und Kohlendioxid zerfällt (Analyse): 4.) Bei 1268 °C unter normalem Luftdruck spaltet sich die chemische Verbindung in Strontiumoxid und Kohlendioxid (ebenfalls eine Analyse): 5.) Die Darstellung von Strontiumcarbonat erfolgt durch Verschmelzen des Minerals Cölestin (SrSO4) mit Soda (Natriumcarbonat, Austauschreaktion, Ionenaustausch): 6.) Die Elemente Magnesium und Iod bilden die Verbindung Magnesiumiodid (Synthese): 7.) Wasser wird durch Elektrolyse in Sauerstoff und Wasserstoff zerlegt (Analyse). 8.) Oft reagiert ein Element mit einer Verbindung, wobei ein anderes Element und eine neue Verbindung entsteht: Beispiel: Elementares Chlor setzt aus Natriumiodid elementares Iod frei und es bildet sich Natriumchlorid (Kochsalz, Redoxreaktion): 9.) Ein ähnliches Beispiel: Auf einem Zinkstab (Reduktionsmittel), der in eine Lösung mit Kupfer(II)-Ionen (Oxidationsmittel) taucht, scheidet sich elementares Kupfer ab (siehe Zementation). Die Lösung wird mit Zink(II)-Ionen angereichert. Redoxreaktionen lassen sich in die Teilreaktionen Oxidation und Reduktion zerlegen: Oxidation: Reduktion: 10.) Wird eine Lösung von Magnesiumiodid mit einer Lösung von Bleichlorid vermischt, fällt gelbes Bleiiodid aus, in der Lösung bleibt Magnesiumchlorid zurück (Fällungsreaktion): Siehe auch
Praxisnahe Beispiele für den Chemieunterricht in der Schule unter: Literatur
|
|
| Dieser Artikel basiert auf dem Artikel Reaktionsschema aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


 ). Es wird auch
). Es wird auch 


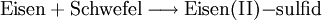 .
.
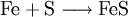 .
.
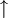 ), ein Pfeil nach unten den Niederschlag eines unlöslichen Feststoffes aus einem flüssigen oder gasförmigen Reaktionsgemisch (
), ein Pfeil nach unten den Niederschlag eines unlöslichen Feststoffes aus einem flüssigen oder gasförmigen Reaktionsgemisch (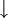 ).
).
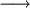 geschrieben, bei umkehrbaren Reaktionen auch als
geschrieben, bei umkehrbaren Reaktionen auch als 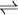 . Diesen Pfeil nennt man auch
. Diesen Pfeil nennt man auch 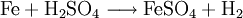 .
.
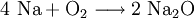
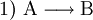 (Stoffumgruppierung)
(Stoffumgruppierung)
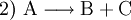 (Stoffzerlegung, Analyse)
(Stoffzerlegung, Analyse)
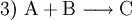 (Stoffvereinigung, Synthese)
(Stoffvereinigung, Synthese)
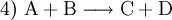 sowie
sowie 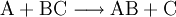 (Stoffumgruppierung in Form von Austauschreaktion – Synthese mit Analyse in Kombination)
(Stoffumgruppierung in Form von Austauschreaktion – Synthese mit Analyse in Kombination)
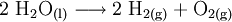
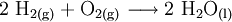
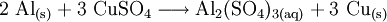
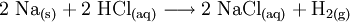
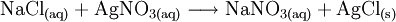
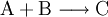 (Stoffvereinigung, Synthese) entsprechend z. B. einfach:
(Stoffvereinigung, Synthese) entsprechend z. B. einfach: 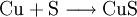 .
.
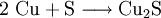
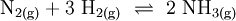 .
.
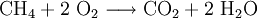
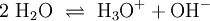
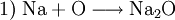 (die Formeln der Stoffe)
(die Formeln der Stoffe)
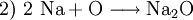 (vorläufiger Ausgleich der Natrium-Atome)
(vorläufiger Ausgleich der Natrium-Atome)
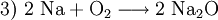 (Ausgleich der Sauerstoffatome)
(Ausgleich der Sauerstoffatome)
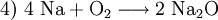 (Erneuter Ausgleich der Natriumatome und Endergebnis)
(Erneuter Ausgleich der Natriumatome und Endergebnis)
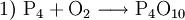 (nicht ausgeglichen, links 2 O-Atome, rechts 10)
(nicht ausgeglichen, links 2 O-Atome, rechts 10)
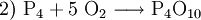 (Ergebnis, ausgeglichenes Schema)
(Ergebnis, ausgeglichenes Schema)
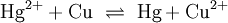
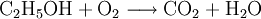 .
.
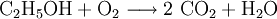
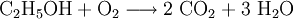
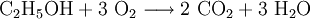
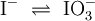
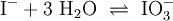 (Wenn man nicht in wässriger Lösung arbeitet fügt man Sauerstoff hinzu O2)
(Wenn man nicht in wässriger Lösung arbeitet fügt man Sauerstoff hinzu O2)
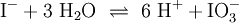
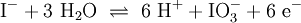
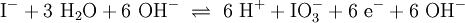
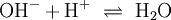
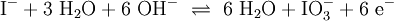
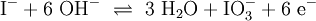
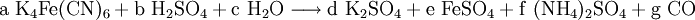
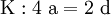
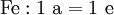
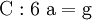
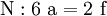
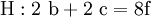
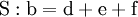
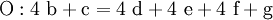
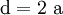
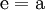
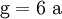
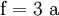
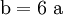
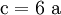
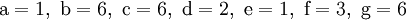
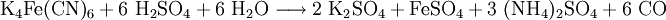
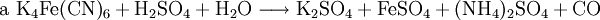
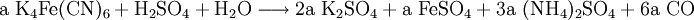
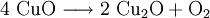
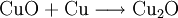
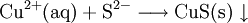
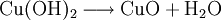
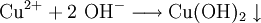
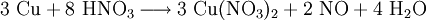
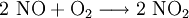
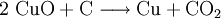
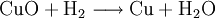
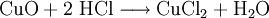
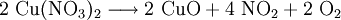
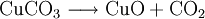
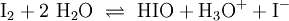 (In einem Liter Wasser lösen sich unter Standardbedingungen etwa 0,29 g Iod.)
(In einem Liter Wasser lösen sich unter Standardbedingungen etwa 0,29 g Iod.)