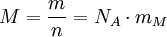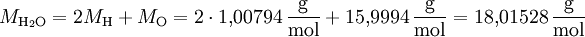Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Molare MasseDie Molare Masse (Formelzeichen M), ist der Quotient aus der Masse einer Substanz und der Stoffmenge dieser Substanz. Die Einheit ist Gramm pro Mol (Einheitenzeichen: g/mol) oder häufig auch Kilogramm pro Kilomol (Einheitenzeichen: kg/kmol). Wie bei allen molaren Größen, bei denen man sich auf die Basisgröße Stoffmenge bezieht, müssen die zugrunde gelegten Teilchen der Substanz genau spezifiziert sein, am besten durch Angabe einer Formel. So muss man beispielsweise zwischen der Molaren Masse eines Wasserstoffatoms H und der Molaren Masse eines Wasserstoffmoleküls H2 unterscheiden, auch wenn man sprachlich ungenau nur von „Wasserstoff“ spricht. Die immer noch häufig benutzte Bezeichnung Molmasse sollte nicht verwendet werden, da sie noch stärker als die Bezeichnung Molare Masse dazu führt zu glauben, dass mit diesen Begriffen eine Masse gemeint ist. Dies ist aber nicht der Fall, da es sich um eine Stoffkonstante einer Substanz handelt. Die früher üblichen Bezeichnungen Atomgewicht, Molekulargewicht bzw. Molgewicht sollten nicht mehr benutzt werden. Sie sind veraltet und streng genommen auch falsch, da ein Gewicht per Definition eine Kraft ist (Einheit: Newton), die sich aus dem Produkt Masse * Beschleunigung errechnet. Die für Gewichte maßgebliche Erdbeschleunigung ist zudem ortsabhängig. Weiteres empfehlenswertes Fachwissen
DefinitionEin Mol einer Substanz ist die Stoffmenge, die aus ebenso vielen Teilchen besteht, wie in zwölf Gramm des Kohlenstoff-Isotops 12C 12C-Atome enthalten sind. Diese Teilchenzahl beträgt etwa 6,022·1023; sie ist identisch mit dem Zahlenwert der Avogadro-Konstante (NA) in der Einheit mol−1. Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
In der Physik wird die Avogadrokonstante gelegentlich auch unter Verwendung der Einheit kmol−1 als 6,022·1026 kmol−1 geschrieben; dann stellen sich nämlich handliche Zahlenwerte für die Masse in der SI-Basiseinheit Kilogramm ein. Beispiel:
Berechnung molarer MassenDie molare Masse einer Verbindung kann berechnet werden, wenn man ihre Summenformel kennt: Zu jedem Element entnimmt man aus der Summenformel den stöchiometrischen Koeffizienten – er steht in der Summenformel hinter dem Elementsymbol. Zu jedem Element muss man dann z.B. aus Tabellen die molare Masse entnehmen – ihr Zahlenwert ist gleich der relativen Atommasse. Dann erhält man die molare Masse als Summe der molaren Massen der Elemente, die die Verbindung aufbauen: Die molare Masse einer Verbindung ist gleich der Summe aus den molaren Massen der Elemente multipliziert mit ihren stöchiometrischen Koeffizienten. Beispiel: Wasser (H2O)
BeispieleAus den molaren Massen der chemischen Elemente kann man die molaren Massen aller Verbindungen berechnen.
Siehe auch
Kategorien: Chemische Größe | Atomphysik | Thermodynamik |
|||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Molare_Masse aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |