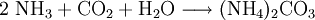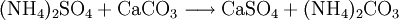Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ammoniumcarbonat
Ammoniumcarbonat, (NH4)2CO3 · H2O, bildet wasserlösliche, farblose, kubische Kristalle mit einer relativen Molekülmasse Mr von 114,10. Es zerfällt bei 58 °C vollständig in Ammoniak, Kohlenstoffdioxid und Wasser. Produkt-HighlightEigenschaftenDas Salz bildet ein farbloses, schwach nach Ammoniak riechendes Pulver. Es hat eine Dichte um 1,6 g·cm-3 (bei 20 °C) und eine hohe Wasserlöslichkeit von ca. 220 g/L. Die Lösung reagiert schwach alkalisch, es stellt sich ein Gleichgewicht zwischen Ammoniak NH3, Ammoniumionen NH4+, Carbonationen CO32-, Hydrogencarbonationen HCO3- und Kohlenstoffdioxid CO2 ein. Das Salz reagiert also mit Wasser und Kohlensäure zu Hydrogencarbonat- und Hydroxidionen. Eine wässrige Lösung von Ammoniumcarbonat ist daher nur im neutralen und schwach basischen Milieu beständig - in Säuren entweicht Kohlenstoffdioxidgas, in konzentrierten Laugen Ammoniakgas. SyntheseDie Darstellung von Ammoniumcarbonat kann durch Umsetzung von Kohlenstoffdioxid mit Ammoniak in wässriger Lösung erfolgen.
Eine weitere Darstellungsmöglichkeit ergibt sich durch Erhitzen von Calciumcarbonat zusammen mit Ammoniumsulfat.
Bei letzterer Methode sublimiert neben dem gewünschten Ammoniumcarbonat auch noch Ammoniumhydrogencarbonat und Ammoniumcarbamat ab, als Feststoff bleibt Calciumsulfat zurück. VerwendungAmmoniumcarbonat wird in der Synthese von Heterocyclen und als Zusatzstoff von fotografischen Entwicklern eingesetzt. Ebenso findet es in der Färberei, als Kohlendioxid-Entwickler in Löschgeräten und als Riechsalz Verwendung. Zudem wird es als Backtriebmittel (auch bekannt als Hirschhornsalz) genutzt. In der EU ist es als Lebensmittelzusatzstoff der Nummer E 503i zugelassen. Ammoniumcarbonat wird häufig in der Anorganischen Chemie für eine Qualitative Analyse verwendet, um im Kationentrenngang aus einer unbekannten Probe die Erdalkalimetall-Kationen von Barium, Strontium und Calcium als eine Gruppe auszufällen, aufzutrennen und mit Hilfe von Nachweisreaktionen zu identifizieren. Kategorien: Reizender Stoff | Ammoniumverbindung | Carbonat |
||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Ammoniumcarbonat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||