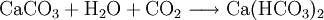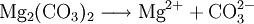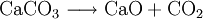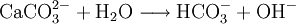Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Carbonate
Auch die Ester der Kohlensäure mit der allgemeinen Strukturformel R-O-C(=O)-O-R', wobei R und R' kohlenstoffhaltige Reste sind, heißen Carbonate. Gehören R und R' zu einem einzigen Molekül, so bildet sich eine ringförmige Verbindung, wie beispielsweise Propylencarbonat. Produkt-Highlight
Eigenschaften von (anorganischen) CarbonatenCarbonate sind ionische Salze und deshalb bei Raumtemperatur in der Regel kristalline Feststoffe. Das Carbonat-Anion bringt keine Eigenfarbe in die Verbindungen ein, so dass deren Farbe ggf. durch das betreffende Kation bestimmt wird. Carbonate sind geruchlos. Mit Ausnahme der Alkali-Carbonate sind sie schlecht wasserlöslich. Reaktionen von Carbonaten
Diese Reaktion spielt sich bei der Lösung von Kalkstein in kohlensäurehaltigem Grundwasser ab. Sie ist der Ursprung der Wasserhärte.
Dies ist die Reaktion bei der Herstellung von Branntkalk. Siehe auch: Carbonat-Silicat-Zyklus Nachweis von CarbonatenAls Vorversuch kann man festes Analysengut mit konzentrierter Salzsäure versetzen. Eine Gasentwicklung (CO2) deutet auf Carbonat hin. Bei Durchführung dieses Tests im Reagenzglas sollte die Flamme eines eingebrachten brennenden Spans erstickt werden. Das entstehende Gas kann auch durch eine Fällungsreaktion identifiziert werden: Man gibt Bariumhydroxidlösung (Barytwasser) in ein Gärröhrchen (Carbonatröhrchen), das an dem einen Ende in einem durchbohrten Stopfen steckt. In das Reagenzglas gibt man die Probe, übergießt sie mit einer Säure (Salzsäure, Schwefelsäure) und verschließt es schnell mit dem Stopfen am Carbonatröhrchen. Nun erhitzt man das Gemisch im Reagenzglas im Wasserbad, wobei bei Anwesenheiten von Carbonaten in der Probe die Bariumhydroxid-Lösung nach und nach getrübt wird, da weißes Bariumcarbonat (BaCO3) ausflockt. Der quantitative Nachweis geringer Carbonatkonzentrationen in Wässern erfolgt zusammen mit der Bestimmung von Hydrogencarbonaten oft durch eine Titration mit Salzsäure ("SBV"): weist das Messgut zu Beginn einen pH-Wert über 8,3 auf, so ist der Salzsäureverbrauch bis zum Erreichen von pH 8,3 äquivalent der Carbonatkonzentration. Der weitere Säureverbrauch bis zum Erreichen von pH 4,3 entspricht der Summe von Carbonat und Hydrogencarbonat. Bei Wässern mit pH-Werten unter 8,3 titriert man gleich nur bis 4,3 (nur noch Hydrogencarbonat) und errechnet den ursprünglichen, dann sehr geringen Anteil an Carbonat-Ionen aus dem Dissoziationsgleichgewicht der Kohlensäure. Carbonate und Hydrogencarbonate können auch durch Ionen-HPLC oder durch Kapillarelektrophorese bestimmt werden. In beiden Fällen wird ein "Gesamtcarbonat" ermittelt und die Komponenten Carbonat, Hydrogencarbonat und "Freie Kohlensäure" unter Berücksichtigung von pH-Wert, Ionenstärke und Temperatur wiederum aus dem Dissoziationsgleichgewicht der Kohlensäure errechnet. Basische ReaktionDie Carbonationen reagieren mit Wasser zu Hydrogencarbonat- und Hydroxidionen. Es handelt sich dabei um die eine basische Reaktion. Vorkommen und Verwendung von Calciumcarbonat („Kalk“)Calciumcarbonat kommt als Kalkstein, Marmor und Kreide rein vor. Es ist ein essentieller bioligischer Mineralstoff und in allen Lebewesen häufig. Die Schalen und Gehäuse von Muscheln und Schnecken sowie die Korallenstöcke bestehen aus diesem Mineral. Verwendet wird er:
Wichtige Carbonate
Organische CarbonateDie kovalenten Carbonate, die sich formal von Alkoholen und Kohlensäure ableiten, kommen natürlich nicht vor. Der einfachste synthetisch hergestellte Kohlensäureester ist Dimethylcarbonat. In den letzten Jahren haben organische Carbonate in polymerer Form als Polycarbonate besonders bei der Produktion von CDs und DVDs größere wirtschaftliche Bedeutung erlangt. Kategorien: Stoffgruppe | Carbonat |
|
| Dieser Artikel basiert auf dem Artikel Carbonate aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |