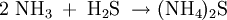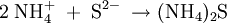Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ammoniumsulfid
Ammoniumsulfid ist das Salz, das entsteht, wenn man Ammoniak (als Gas oder in Lösung) mit Schwefelwasserstoff reagieren lässt. Produkt-Highlight
VorkommenIn der Natur entsteht es als Produkt von Fäulnisprozessen. Als Rauch kommt es in Form von Wolken sogar in der Atmosphäre des Riesenplaneten Jupiter vor. Gewinnung und DarstellungDie Stoffgleichung lautet: VerwendungAmmoniumsulfid wird häufig in der anorganischen Chemie für eine Qualitative Analyse verwendet, um im Kationentrenngang in der Ammoniumsulfidgruppe aus einer unbekannten Probe die Schwermetallkationen der Elemente Nickel, Cobalt, Eisen, Mangan, Chrom, Aluminium und Zink als eine Gruppe auszufällen, aufzutrennen und mithilfe von Nachweisreaktionen zu identifizieren. Das Salz reagiert mit Wasser zu Hydrogensulfid- und Hydroxidionen. Eine wässrige Lösung von Ammoniumsulfid ist daher nur im neutralen und schwach basischen Milieu beständig - in Säuren entweicht Schwefelwasserstoffgas, in konzentrierten Laugen Ammoniakgas. Quellen
Kategorien: Feuergefährlicher Stoff | Ätzender Stoff | Ammoniumverbindung | Sulfid |
||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Ammoniumsulfid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||