Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AmmoniumsulfidgruppeDie Ammoniumsulfid-Gruppe ((NH4)2S -Gruppe) ist Bestandteil des Kationentrenngangs, einem klassischen Verfahren der qualitativen Analyse in der Anorganischen Chemie. Sie fällt aus dem Filtrat der Schwefelwasserstoffgruppe aus, wenn dieses mit dem Trennmittel Ammoniumsulfid versetzt wird (eine sog. Sulfidfällung). Zur Ammoniumsulfid-Gruppe gehören nämlich diejenigen Elemente, die mit dem Trennmittel schwerlösliche Sulfide bilden (Fällungsreaktion). Die Sulfidfällung im basischen Bereich (idealerweise mit Ammoniak/Ammoniumchlorid-Pufferlösung bei pH-Werten um 8 bis 9) dient also im vereinfachten Kationentrenngang zur Abtrennung von Schwermetallkationen wie Co(II),Ni(II),Mn(II),Zn(II),Eisen(II,III) – Ausfällung als Sulfide – sowie Al(III),Cr(III) und z.T. auch Fe(II,III), die als Hydroxide ausfallen.
Produkt-HighlightMögliche Untergruppen: Urotropin- und AmmoniumsulfidgruppeIm erweiterten Trenngang unterteilt man die Ammoniumsulfidgruppe in zwei Untergruppen: Urotropin-Gruppe (=Hexamethylentetramin): Fe2+/3+, Ti2+/4+, La3+, Al3+, Cr3+/6+ und: Ammoniumsulfid-Gruppe ((NH4)2S) im engeren Sinne: Ni2+, Co2+, Fe2+/3+, Mn2+, Cr3+, Al3+, Zn2+, Ti2+/4+, V2+, W3+ Die Abbildung rechts zeigt die neutralen Salzlösungen der Kationen Fe(III),Cr(III),Al(III),Ni(II) (linke Bildhälfte, von links nach rechts) sowie deren mit Urotropin bzw. Ammoniak auftretenden, typisch gefärbten Hydroxid-Niederschläge (in gleicher Reihenfolge). Sulfid-Niederschläge sind zusätzlich in der Schwefelwasserstoffgruppe abgebildet. Im folgenden wird kurz der vereinfachte Standardtrennungsgang beschrieben. Verfahren1. Schritt: Die Gruppenfällung mit AmmoniumsulfidlösungBei einem pH-Wert von 8 bis 9 fallen in (NH4)2S -haltiger Lösung die Sulfide von Co(II),Ni(II),Mn(II),Zn(II),Eisen(II,III) – letzteres als FeS (Redoxreaktion mit Sulfidanionen als Reduktionsmittel für Eisen-III-Kationen). Bei der Ausfällung der (NH4)2S -Gruppe bilden sich neben diesen Sulfidniederschlägen auch Ausfällungen von Aluminium- und Chromhydroxid. Die Ursache zeigt sich beim Vergleich der Löslichkeitsprodukte zu Ammoniumsulfidgruppe. Das Filtrat der Schwefelwasserstoffgruppe wird dazu in einer Porzellanschale oder einem kleinen Becherglas unter Zusatz von 1 Spatelspitze festem Ammoniumchlorid auf ca. 1 mL eingeengt. Bis zur deutlich alkalischen Reaktion wird konz Ammoniak zugeträufelt,mit 1-2 mL Ammoniumsulfidlösung versetzt und der Nd. einige min. erwärmt, dann abfiltriert. 1 Tropfen Filtrat wird mit 1 Tropfen Blei-II-acetat versetzt (oder auf Bleiacetatpapier gegeben). Schwarzes PbS zeigt Vollständigkeit der Fällung an. Der Nd. wird sofort mit stark verdünnter Ammoniumsulfidlösung gewaschen. (Hinweis: Bei orangeroter oder violetter Farbe zuvor mit Ethanol kochen! - Filtrat prüfen: Bei gelbbrauner Trübung durch NiS-Kolloid mit Ammoniumacetat und Filterpapierschnipseln kochen und neu filtrieren. Das wird u.U. erforderlich, denn NiS und CoS bilden Kolloide; Kolloide sind große Molekülverbände, wobei die Moleküle nur durch intermolekulare Kräfte zusammengehalten werden (Dipol, Wasserstoffbrücken). Durch ihre molekulare Struktur (hydrophile und lipophile Bereiche der Seifenmoleküle) oder durch elektrische Ladungen werden diesese Molekülaggregate in Lösung gehalten (kolloidale Lösung; Thyndall-Effekt). Das Erwärmen der Lösung mit Filterpapierschnitzel führt zu einer Vergerößerung der Teilchen, die man filtrieren kann. Durch Zugabe von Ammoniumacetat kann die elektrische Ladung aufgehoben werden und die Aggregate fallen aus). 2.Schritt: Abtrennung und Nachweis von Cobalt und NickelDer Sulfidniederschlag wird sofort mit 1-2 mL verdünnter Salzsäure behandelt, um anschließend den ungelösten Rest (CoS,NiS) abzufiltrieren und in je einigen mL verdünnter Essigsäure und konz. Wasserstoffperoxidlösung zu lösen. Danach ist aus der essigsaueren Co-Ni-Lösung Fe-Reste mit Ammoniak auszufällen, abzufiltrieren und vom Fe-Rest befreites Filtrat für die einzelnen Nachweisreaktionen von Co und Ni zu nutzen. 3.Schritt: Abtrennung von Eisen-III-Hydroxid und Braunstein (Manganoxidhydroxid)Von Ni + Co befreites Filtrat der Sulfide aufkochen, konz. Salpetersäure zugeben und eindampfen, neutralisierte Rest-Tröpfchen in alkalisches Bad geben (aus Ätznatron und konz. Wasserstoffperoxid) und erhitzen, abfiltrierten Nd. mit warmem Wasser waschen, in HCl lösen; in einem Teil der Lösung Fe nachweisen, den anderen Teil 2 mal mit 1 mL konz Salpetersäure abrauchen und mit konz. Salpetersäure und Blei-IV-oxid aufkochen, filtrieren (Nachweisreaktion: Violettfärbung zeigt Permanganat an). 4.Schritt: Abtrennung von Aluminiumhydroxidstark alkalische Lösung durch Kochen von Wasserstoffperoxid befreien (Nachweisreaktion: bei Gelbfärbung Chromat!), mit HCl neutralisieren, einige Tropfen Ammoniak und 2-3 Spatelspitze Ammoniumchlorid zugeben, aufkochen, den weißen Aluminiumhydroxid-Niederschlag abfiltrieren und Al-Einzelnachweis durchführen. 5.Schritt: Abtrennung von Chrom(at) zum Nachweis von Zink
Filtrat vom Aluminiumhydroxid-Nd. bei Gelbfärbg. mit Bariumchlorid-Lösung behandeln (nach Pufferung mit HAc/NaAc!) und Bariumchromat abfiltrieren, gelben Filterrückstand in verdünnter Schwefelsäure lösen, mit Wasserstoffperoxid und Ether schütteln (Nachweisreaktion ähnlich wie beim alkalischen Bad: zusätzl. Chromnachweis, kann bei eindeutiger Vorprobe und Gelbfärbung u.U. entfallen/ VORSICHT: Etherdämpfe können sich in Flammennähe explosionsartig entzünden!). In schwach essigsaures Filtrat vom Bariumchromat Schwefelwasserstoff-Gas einleiten, weißen ZnS-Niederschlag abfiltrieren, in HCl lösen, mit NaOH kochen und - falls nötig - störende Niederschläge abfiltrieren (im Filtrat ist Zn als Hydroxo-Zinkat-Komplex farblos gelöst), mit HAc/NaAc puffern und erneut ZnS zum Zn-Einzelnachweis ausfällen. Ergänzendes; NachweisreaktionenAuch diese Gruppe macht sich im Verlauf des Kationentrennganges/der Analyse z.T. früh bemerkbar: VorprobenBei Vorproben zur Ammoniumsulfidgruppe tritt beim Schmelzen der Salzperle mit Phosphorsalz NaNH4HPO4 oder Borax (Dinatriumtetraborat) Na2B4O7 eine charakteristische Färbung mit Schwermetallsalzen auf: a) Die Boraxperle wird durch Co, Ni, Cr gefärbt; b) Die Phosphorsalzperle mit Natriumammoniumhydrogenphosphat für Co, Ni, Cr wird ebenfalls charakteristisch gefärbt; c) Oxidationsschmelze für Mn (Violettfärbung durch Permanganat-Ionen) und Cr (Gelbfärbung, Chromat): Braunstein und Chrom-III-oxid können unter Zuhilfenahme der Oxidationsschmelze aufgeschlossen werden (Soda-Salpeter-Aufschluss). Dazu wird die Substanz mit der drei- bis siebenfachen Menge einer Mischung aus Natriumcarbonat (Soda) und Kaliumnitrat (Salpeter) im Porzellantiegel aufgeschmolzen. Dabei wird die Substanz oxidiert (Redoxreaktion) und das zugesetzte Nitrat zu Nitrit reduziert. Beispiel: Oxidationsschmelze von Chrom-(III)-Oxid (grün) zu gelbem Chromat
Beispiel: Oxidationsschmelze von Eisen-(II)-Chromit zu gelbem Chromat und Eisen-III-oxid
AufschlüsseZur Ammoniumsulfidgruppe ggf. erforderliche Aufschlüsse / Saurer Aufschluss oderOxidationsschmelzen (s.o.): Eisen-III-oxid - braun; Aluminiumoxid - weiß, körnig; Chrom-III-oxid - grün, samtartig; Spinelle mit CoO, NiO u.a. (Spinelle sind Doppeloxide, wobei die Kationen und die Sauerstoffionen jeweils in die Zwischenräume des anderen Kristallgitters passen (Bsp. Thénards Blau) NachweiseDie Einzelnachweise zur Ammoniumsulfidgruppe verlaufen über folgende Nachweisreaktionen:
3 H2O2 + 2 Cr3+ + 10 OH- ---> 2 CrO42- (gelb) + 8 H2O
Auch bei den Vorproben tritt beim Schmelzen der Salzperle mit Phosphorsalz NaNH4HPO4 oder Borax (Dinatriumtetraborat) Na2B4O7 tritt eine charakteristische Färbung mit Schwermetallsalzen auf (mit Cr3+ grün). Bei der Oxidationsschmelze mit Soda und Salpeter hingegen wird Chrom-III zu Chromat oxidiert (Gelbfärbung). Chromat ergibt als Bariumchromat gelben Niederschlag (bei Zugabe von verdünnter Bariumchlorid-Lösung). Literatur
Kategorien: Nachweisreaktion | Chemisches Analyseverfahren |
| Dieser Artikel basiert auf dem Artikel Ammoniumsulfidgruppe aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |




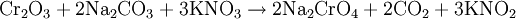
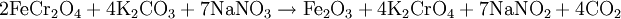
![\mathrm{4\,Fe^{3\operatorname{+}} + 3\,K_4[Fe(CN)_6]_{(aq)} \longrightarrow Fe_4[Fe(CN)_6]_3 + 12\,K^{\operatorname{+}}}](images/math/c/6/e/c6e9e30644e416ec01cfb96a58faf7f7.png)


