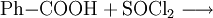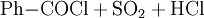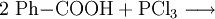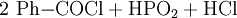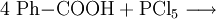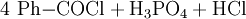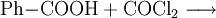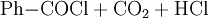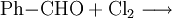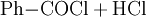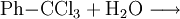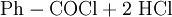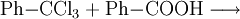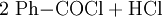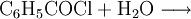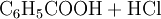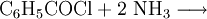Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Benzoylchlorid
Benzoylchlorid ist eine farblose, an der Luft infolge Zersetzung zu Chlorwasserstoff leicht rauchende Flüssigkeit. Formal ist sie das Chlorid der Benzoesäure. Die unangenehm und stechend riechenden Dämpfe reizen Atemwege und Augen. Produkt-Highlight
Gewinnung und DarstellungBenzoylchlorid lässt sich durch die Umsetzung von Benzoesäure mit Thionylchlorid (oder auch mit Phosphor(III)-chlorid und Phosphor(V)-chlorid, oder Phosgen) herstellen. Wichtigste Methoden der industriellen Herstellung des Benzoylchlorids sind jedoch die Chlorierung von Benzaldehyd: sowie die regulierte Hydrolyse von Benztrichlorid: oder dessen Reaktion mit Benzoesäure: EigenschaftenBenzoylchlorid ist eine schwer entzündliche Flüssigkeit (Flammpunkt zwischen 55 und 100 °C), deren Dämpfe mit Luft beim Erhitzen des Stoffes über seinen Flammpunkt ein explosionsfähiges Gemisch bilden können. Chemische EigenschaftenBenzoylchlorid reagiert in einer heftigen Hydrolysereaktion mit Wasser zu Benzoesäure und Salzsäure.
VerwendungBenzoylchlorid wird u. a. zur Herstellung von Benzoesäureestern verwendet. Die Verwendung von Carbonsäurechloriden anstelle der Carbonsäuren liefert deutlich höhere Ausbeuten. SicherheitshinweiseBeim Kontakt mit Wasser (z. B. aus der Luft) entstehen gefährliche Chlorwasserstoff-Dämpfe. Jeglicher Hautkontakt ist zu vermeiden, Benzoylchlorid verursacht schmerzhafte Verätzungen. Unbedingt vermieden werden sollte das Einatmen der Dämpfe. Im Tierversuch erwies sich Benzoylchlorid (wahrscheinlich wegen der extrem schnellen Metabolisierung zu Benzoesäure, Hippursäure und Chlorwasserstoff) nicht als genotoxisch. Aussagen zur Kanzerogenität können zur Zeit nicht getroffen werden [2] QuellenangabenKategorien: Ätzender Stoff | Carbonsäurechlorid | Aromat |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Benzoylchlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||