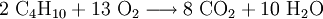Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Butan
Butan ist die Bezeichnung für zwei gasförmige, farblose, gesättigte Kohlenwasserstoffe (Alkane), die in den zwei strukturisomeren Formen (n-)Butan CH3-CH2-CH2-CH3 und Methylpropan (Isobutan) CH(CH3)3 auftreten. Davon abgeleitet sind der Butyl- und Isobutyl-Rest (C4H9)-, die in vielen chemischen Verbindungen auftreten. Produkt-Highlight
EigenschaftenBeide Butan-Isomere sind bei Raumtemperatur Gase, denn (n-)Butan hat einen Schmelzpunkt von −138 °C und einen Siedepunkt von −0,5 °C und Methylpropan (Isobutan) hat einen Schmelzpunkt von −160 °C und einen Siedepunkt von −12 °C. In Wasser ist Butan nahezu unlöslich (90 mg/l). Beide Isomere verhalten sich chemisch ähnlich: sie sind brennbar, entfärben Bromwasser und Kaliumpermanganatlösung nicht und werden von den Halogenen Chlor und Brom nur unter Lichteinfluss angegriffen.
Verwendung und HerstellungButan und Methylpropan sind Flüssiggase, die bei der Erdöldestillation anfallen. Sie kommen im Erdöl und Erdgas vor. Butan wird zur Herstellung von Butadien und Maleinsäure und seit dem FCKW-Verbot als Treibgas in Sprays verwendet. Beide Isomere werden als Brenngas in Tanks und Feuerzeugen, oft im Gemisch mit Propan, eingesetzt. Butan wird trotz der Brennbarkeit wieder im Kühlschrank als Kältemittel eingesetzt (Kältemittelbezeichnung Butan R600 Methylpropan R600a), da die nicht brennbaren Fluorchlorkohlenwasserstoffe (FCKW) schädlich für die äußere Ozonschicht der Erdatmosphäre sind und die Ausbildung des Ozonlochs fördern. Als Kühlmittel im Gefrierbereich ist es wegen des Siedepunkts von −0,5 °C ungeeignet. Manche Solarkollektoren verwenden Methylpropan als Wärmeträger. Zur Verwendung in der Baubranche (Brenner) ist es ungeeignet, da bei niedrigen Temperaturen kein Gasdruck entsteht. ReaktionenUnter günstigen Bedingungen oxidiert Butan zu Kohlenstoffdioxid und Wasser. Butan als DrogeButan wird als Rauschgift wegen der hohen Verfügbarkeit verwendet. Ein Grund, wieso Butan als Rauschgift verwendet wird, ist, dass es billiger ist als Lachgaskapseln. Deshalb steigen einige psychisch abhängige Konsumenten auf Butangas in Dosen um. Die Wirkung: Gehobene, gelöste Stimmung und Benebelung; kurzer, intensiver Rausch, Wärmegefühl, erhöhter Speichelfluss, Brummen in den Ohren („Hubschrauber“). Viele Personen erleben selbstrekursive Déjà-vus. Häufig ist die Steuerungsfähigkeit des Gefühlslebens eingeschränkt; reduziertes Schmerzempfinden. Eine Beschreibung, die man überall findet ist die, dass man während der Wirkung Musik am eigenen Körper spürt. Oft wird auch beschrieben, dass man selber die Musik sei. Beim Konsum über eine größere Menge kann Butangas sehr heftige und auch sehr real wirkende Halluzinationen hervorrufen. Die Wirkung bei einer Dosis vorzugsweise 100 ml flüssigen Butan hält ja nach Atemtechnik und Person etwa eine Stunde an. Das Risiko: Es kann zu einer Sauerstoffunterversorgung kommen, die zu Übelkeit und Erbrechen, im schlimmsten Fall zu massiven Hirnschädigungen führt. Lebensgefahr bei Erhöhung des Gehirndrucks. Steigerung der Krampfanfälligkeit durch Senkung der Krampfschwelle. Psychische Abhängigkeit ist möglich. In geschlossenen kleinen Räumen (Auto) kann es zudem zu einem hochexplosivem Gas-Luftgemisch kommen.[3] Auch von Todesfällen wird berichtet.[4] Quellen
Literatur
Kategorien: Feuergefährlicher Stoff | Alkan | Gas |
|||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Butan aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||