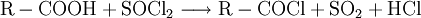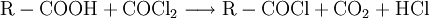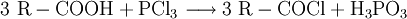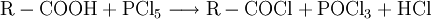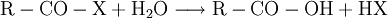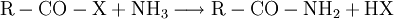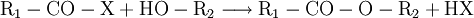Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
CarbonsäurehalogenideCarbonsäurehalogenide sind Verbindungen einer Stoffgruppe, die sich von den Carbonsäuren ableiten. Bei ihnen ist die Hydroxylgruppe der Carbonsäure durch ein Halogen-Atom ersetzt. Die am häufigsten verwendeten Carbonsäurehalogenide sind die Carbonsäurechloride. Produkt-Highlight
NomenklaturDie Benennung kann entweder als Säurehalogenid, ausgehend vom Acylrest, oder als Halogencarbonyl erfolgen. Beispiele:
DarstellungCarbonsäurechloride sind durch Reaktion der Carbonsäuren mit Thionylchlorid (SOCl2), Phosgen (COCl2), Phosphor(III)-chlorid oder Phosphor(V)-chlorid herstellbar. Die Fluor- und Bromanaloga reagieren identisch. Das Thionylchlorid besitzt den Vorteil, dass alle entstehenden Stoffe außer dem gewünschten Säurechlorid gasförmig sind: EigenschaftenDie niedermolekularen Carbonsäurehalogenide sind (mit Ausnahme des gasförmigen Formylfluorid) farblose, stechend riechende Flüssigkeiten, die an feuchter Luft wegen der Hydrolyse zu Carbonsäuren und Halogenwasserstoffsäuren rauchen. Im Vergleich zur jeweiligen Carbonsäure liegen Schmelz- und Siedepunkte niedriger, da sich keine Wasserstoffbrückenbindungen ausbilden können. Alle Carbonsäurehalogenide sind brennbar. Durch den -I-Effekt des Halogenatoms ist das Kohlenstoffatom der Carbonylgruppe stärker positiv geladen und dadurch deutlich reaktiver als das der entsprechenden Carbonsäure. HydrolyseMit Wasser reagieren die Carbonylhalogenide unter stürmischer, stark exothermer Reaktion zu den jeweiligen Carbonsäuren und der Halogenwasserstoffsäure: AmidbildungDurch Reaktion mit Ammoniak lassen sich die entsprechenden Carbonsäureamide herstellen: EsterbildungDurch Reaktion mit Alkoholen lassen sich die entsprechenden Carbonsäureester darstellen: Diese Reaktion ist im Gegensatz zu derjenigen von Carbonsäuren und Alkoholen irreversibel. VerwendungDie Carbonsäurehalogenide sind die Carbonylverbindungen mit der größten Reaktivität. Deshalb laufen viele Reaktionen, die ausgehend von der reinen Carbonsäure nur unter besonderen Bedingungen möglich sind, wesentlich leichter ab. Beispiele für die Verwendung sind Darstellung der Carbonsäureester oder Friedel-Crafts-Acylierungen. SicherheitshinweiseDa die Carbonsäurehalogenide sehr leicht und unter Hitzeentwicklung hydrolysieren, müssen diese möglichst trocken gelagert werden. Entweichende Halogenwasserstoffsäuren reizen Schleimhäute, Augen und Haut. Die Reaktion mit niedrigen Alkoholen verläuft meist ähnlich stürmisch unter Bildung des Esters und der Halogenwasserstoffsäure. Alle Carbonylhalogenide sind außerdem brennbar. Links
Kategorien: Stoffgruppe | Carbonsäurehalogenid |
|
| Dieser Artikel basiert auf dem Artikel Carbonsäurehalogenide aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |