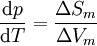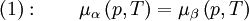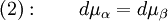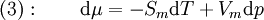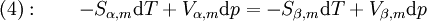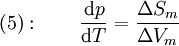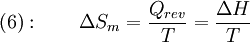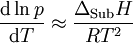Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Clapeyron-GleichungMit der Clapeyron-Gleichung, die Benoit Clapeyron 1834 entwickelte, erhält man die Steigung von Phasengrenzlinien in einem Phasendiagramm. Sie lässt sich für verschiedene Fälle spezifizieren. Aus der Clapeyron-Gleichung wurde auch die Clausius-Clapeyron-Gleichung entwickelt. Sie lautet: Produkt-HighlightHerleitungAn einer Phasengrenzlinie, d.h. bei dem Wertepaar aus Temperatur T und Druck p, in dem zwei Phasen α und β im Gleichgewicht koexistieren, besitzen diese beiden Phasen die gleichen chemischen Potenziale, es gilt: Um nun die Steigung der Phasengrenzlinien bestimmen zu können, gilt es die Funktion dp / dT zu finden, die diese beschreibt. Da auf der gesamten Phasengrenzlinie gilt, dass auch bei infinitesimalen Veränderung von p oder T die Gleichung 1 gilt, muss auch die Veränderung der Potenziale μα und μβ immer gleich bleiben. Mathematisch bedeutet das: Aus den charakteristischen Funktionen und somit im Endeffekt aus den Fundamentalgleichungen der Thermodynamik ist bekannt, dass wobei Sm und Vm molare Größen seien. Setzt man nun dies in Gleichung 2 ein, so erhält man Durch Ausklammern von dp und dT sowie anschließender Umformung erhält man nun die Clapeyron-Gleichung:
Für reversible Vorgänge kann die Umwandlungsentropie aus der dabei umgesetzten Wärmemenge Qrev berechnet werden, die bei isobaren Vorgängen gleich ist der Änderung der molaren Enthalpie: Damit erhält man aus der Clapeyron-Gleichung die Clausius-Clapeyron-Gleichung.
|
| Dieser Artikel basiert auf dem Artikel Clapeyron-Gleichung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |