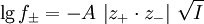Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Debye-Hückel-TheorieDie Debye-Hückel-Theorie (nach Peter Debye und Erich Hückel) beschreibt die elektrostatischen Wechselwirkungen von Ionen in Elektrolyten. Diese Coulombschen Anziehungs- und Abstoßungskräfte führen zu einer Abweichung der Aktivität ai (wirksame Konzentration, früher „aktive Masse“) der Ionensorte i von ihrer molaren Konzentration ci gemäß Produkt-Highlight
GrundlagenModellvorstellungEntgegengesetzt geladene Ionen ziehen sich an, gleichnamig geladene Ionen stoßen sich ab. Aus diesen Gründen sind Ionen in einer Lösung nicht willkürlich verteilt, sondern besitzen eine gewisse Nahordnung, in der Anionen eher in der Nähe von Kationen zu finden sind und umgekehrt (Abb.). Elektroneutralität der Lösung ist dabei gewahrt. Im Gegensatz zum Ionengitter können sich Ionen in Lösung nicht vollständig regelmäßig anordnen, weil Lösungsmittelmoleküle als Dielektrikum die Coulombschen Wechselwirkungen abschwächen, worauf die thermische Bewegung zu einer stärkeren Verteilung der Ionen führt. Im zeitlichen Mittel befindet sich aber jedes Ion im Zentrum einer Wolke aus entgegengesetzt geladenen Ionen (in der Abb. durch Kreise angedeutet). Diese Ionenwolken schirmen die Ladung des Zentralions ab, was der Grund für die Einführung der Aktivität als "wirksame Konzentration" bei Ionen ist. Wichtige GrößenAusgehend von diesen Modellvorstellungen haben P. Debye und E. Hückel durch Kombination der Poisson-Gleichung mit der Boltzmann-Statistik zur Beschreibung der Ionenverteilung einige in der Elektrochemie häufig benutzte Gleichungen abgeleitet. Zur Vereinfachung benutzten sie dabei die folgenden Größen
ErgebnisseAktivitätskoeffizient f der Ionensorte i
Radius der IonenwolkeEs stellte sich heraus, dass sich das Inverse von κ als Radius der Ionenwolke interpretieren lässt.
Diesen Radius nennt man auch Abschirmlänge oder Debye-Länge. Debye-Hückel-Grenzgesetz
Darin ist A = 0.509 dm3/2 mol-1/2 zu setzen, wenn Wasser bei 25°C als Lösungsmittel verwendet wird. Für andere Temperaturen und/oder Lösungsmittel muss es nach der oben angegebenen Gleichung berechnet werden. Das ist die für praktische Belange am häufigsten zitierte Gleichung, die sich in der Näherung Mittlerer Aktivitätskoeffizient und Debye-Hückel-GrenzgesetzIndividuelle Aktivitätskoeffizienten (bzw. -aktivitäten) können zwar berechnet, aber aufgrund der Elektroneutralitätsbedingung nicht gemessen werden. Für den messbaren mittleren Aktivitätskoeffizienten eines Elektrolyten gilt
Näheres s. Aktivität. Literatur
|
|||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Debye-Hückel-Theorie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


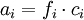 . Die Debye-Hückel-Theorie liefert Gleichungen, mit denen der individuelle Aktivitätskoeffizient
. Die Debye-Hückel-Theorie liefert Gleichungen, mit denen der individuelle Aktivitätskoeffizient 


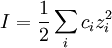
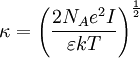
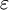
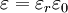
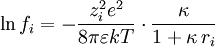
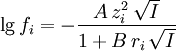
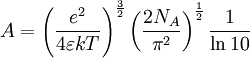
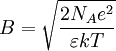
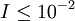 mol dm-3.
mol dm-3.
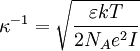
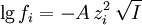
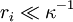 ergibt. Sie gilt also für Ionenwolken, die wesentlich größer sind als das umschlossene Ion. In der Regel sind das sehr verdünnte Lösungen mit
ergibt. Sie gilt also für Ionenwolken, die wesentlich größer sind als das umschlossene Ion. In der Regel sind das sehr verdünnte Lösungen mit 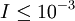 mol dm-3.
mol dm-3.