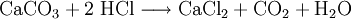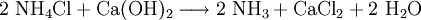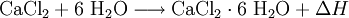Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Calciumchlorid
| Kristallstruktur ||Rutil (verzerrt), oktaedrisch Calciumchlorid (auch Kalziumchlorid) ist ein Chlorid des Erdalkalimetalls Calcium mit der Summenformel CaCl2. Calcium liegt dabei in der Oxidationsstufe +2 vor, Chlor hat die Oxidationstufe −1. Produkt-Highlight
GeschichteUm 1860 gelang den Chemikern Robert Wilhelm Bunsen und Matthiessen die erste Reindarstellung des Elementes Calcium durch die Schmelzelektrolyse von Calciumchlorid. VorkommenCalciumchlorid kommt in der Natur gelöst in Salzsolen vor.
Gewinnung und DarstellungCalciumchlorid wird aus Salzsäure und Calciumcarbonat hergestellt: Anschließendes Erhitzen auf 260 °C liefert die wasserfreie Form. Technisch wird Calciumchlorid als Abfallprodukt bei der Sodaherstellung mit dem Solvay-Verfahren – und zwar bei der Rückgewinnung des Ammoniaks aus dem dabei entstandenen Ammoniumchlorid – erhalten: EigenschaftenCalciumchlorid ist ein Salz. Calcium und Chlor liegen aufgrund des großen Elektronegativitätsunterschiedes als Ionen vor. Die Bindung erfolgt somit über elektrostatische Wechselwirkungen. Calciumchlorid bildet in Reinform farblose Kristalle und ist in wasserfreiem Zustand stark hygroskopisch. Es nimmt leicht Wasser aus seiner Umgebung auf und bildet dabei einen Hydrat-Komplex. Reaktionen
Die Kristalle des Hexahydrats lösen sich bei ungefähr 30 °C im eigenen Kristallwasser. Erhitzen auf ungefähr 200 °C setzt das gebundene Wasser wieder frei. Das Auflösen in Wasser führt im Gegensatz zu wasserfreiem Calciumchlorid zu einer starken Abkühlung. Beide Calciumchlorid-Formen sind zudem gut löslich in Ethanol.
VerwendungWasserfreies Calciumchlorid ist aufgrund seiner Hygroskopie ein wichtiges Trocknungsmittel im Labor, beispielsweise im Exsikkator, und in der technischen Chemie für verschiedenste Gase und Flüssigkeiten. Anwendungsfelder sind die Trocknung von Wohnräumen, der Einsatz als Frostschutzmittel, im speziellen als Frostschutzmittel und Abbindebeschleuniger im Beton, sowie als Staubbindemittel (z. B. auf Baustellen). In der Medizin wird es als Mittel zur Stillung von Blutungen und bei Kalkmangelkrankheiten sowie als Heilmittel gegen Frostbeulen und Allergien eingesetzt. Es wird als Festigungsmittel, Geschmacksverstärker und Stabilisator eingesetzt (unter anderem bei der Trinkwasseraufbereitung, Oberflächenbehandlung von Obst). Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 509 zugelassen. Unter Ausnutzung der exothermen Hydratation bei der Reaktion mit Wasser findet Calciumchlorid Einsatz zur Erwärmung von Fertiggetränken. Darüber hinaus kommt es als Streusalz sowie zur Herstellung von Kältemischungen zum Einsatz (siehe oben). Weiterhin dient es zur Gerinnung von Eiweißen in der Lebensmitteltechnologie und findet Anwendung bei der Herstellung von Produkten wie Tofu oder künstlichem Kaviar. Quellen
Kategorien: Reizender Stoff | Chlorid | Calciumverbindung | Arzneistoff |
|||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Calciumchlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||