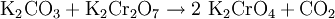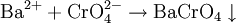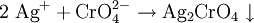Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kaliumchromat
Kaliumchromat ist ein Kaliumsalz der Chromsäure (H2CrO4). Es ist ein nicht brennbarer, zitronengelber, giftiger und umweltgefährlicher Feststoff. Es ist ein starkes Oxidationsmittel und wirkt ätzend auf Haut und Schleimhäute. Produkt-Highlight
Gewinnung und DarstellungDurch die Reaktion von Kaliumcarbonat und Kaliumdichromat wird Kaliumchromat hergestellt. EigenschaftenWasserfreies Kaliumchromat bildet zitronengelbe, prismenförmige Kristalle, welche sich oberhalb von 670°C in eine rote hexagonale α-Modifaktion umwandeln. Bei Berührung mit brennbaren Stoffen ist das Salz feuergefährlich.
VerwendungKaliumchromat wurde fast vollständig durch das preiswertere Natriumchromat ersetzt und wird nur noch für sehr spezifische Anwendungen, wie beispielsweise in der Fotografie oder als Indikator bei der Titration von Natriumchlorid nach Mohr verwendet (DAB7). SicherheitshinweiseKaliumchromat ist giftig und umweltgefährlich. Es führt zu Reizung und Schädigung von Haut und Schleimhäuten und schädigt Nieren, Blut und Leber. Kaliumchromat wirkt weiterhin mutagen und kanzerogen. Kaliumchromat verursacht an verletzten Hautstellen schlecht heilende Wunden. NachweisDas Chromat-Anion (CrO42-) lässt sich in wässriger Lösung mit Metallkationen wie Ba2+ Pb2+, Hg22+ als, je nach Kation gelber bis braunroter, Niederschlag ausfällen: Es ist dabei zu beachten, dass in sehr sauren Lösungen das Chromat-Dichromat-Gleichgewicht zunehmend zum Dichromat verschoben ist. Quellen
Kategorien: Giftiger Stoff | Umweltgefährlicher Stoff | Chromat | Kaliumverbindung |
||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kaliumchromat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||