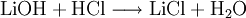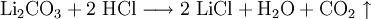Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Lithiumchlorid
Lithiumchlorid LiCl, das Lithiumsalz der Chlorwasserstoffsäure bildet farblose, stark hygroskopische Kristalle. Neben dem wasserfreien Lithiumchlorid existieren noch verschiedene Hydrate, bekannt sind LiCl · n H2O mit n= 1, 3 und 5. Produkt-Highlight
EigenschaftenLithiumchloridlösungen sind stark hygroskopisch. Sie reduzieren den Wasserdampfdruck um ca. 90 %. Aus konzentrierten wässrigen Lösungen kristallisiert wasserfreies Lithiumchlorid erst bei Temperaturen oberhalb von 98 °C aus. Bei niedrigeren Temperaturen erhält man eine der Hydratformen. Die Löslichkeit in Wasser beträgt ca. 450 g LiCl/kg Lösung. Gasförmiges Lithiumchlorid bildet planare Ringe aus mehreren Lithiumchloridmolekülen (Di-, Tri- und Oligomere). Lithiumchloridlösungen sind sehr korrosiv. Zur Handhabung konzentrierter Lösungen sind geeignete Werkstoffe auszuwählen. Lithiumchloridlösungen schädigen auch Beton. DarstellungDie Gewinnung von Lithiumchlorid erfolgt durch Umsetzung einer wässrigen Lithiumhydroxid- oder Lithiumcarbonatlösung mit Chlorwasserstoff und anschließender Aufkonzentrierung und Trocknung. Technisch relevant ist zur Zeit nur die Umsetzung von Lithiumcarbonat mit Salzsäure mit anschließender Einengung unter Kristallisation von Lithiumchlorid in Vakuumverdampfern. Verwendung
Quellen
Kategorien: Gesundheitsschädlicher Stoff | Lithiumverbindung | Chlorid |
|||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Lithiumchlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||