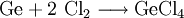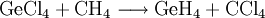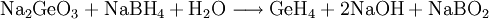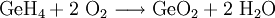Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Monogerman
Monogerman (GeH4) ist die einfachste chemische Verbindung aus der Gruppe der Germane (eine Verbindung aus Germanium und Wasserstoff). Es ist ein sehr reaktionsfreudiges, giftiges, leicht zersetzliches und geruchloses Gas und findet Anwendung in der Halbleitertechnologie. Produkt-Highlight
VorkommenMonogerman wurde in der Jupiteratmosphäre nachgewiesen[2]. Gewinnung und DarstellungMonogerman entsteht bei der Zersetzung salzartiger Germanide (Germanium-Metallverbindungen) in Säuren, wie zum Beispiel Magnesiumgermanid in Bromwasserstoffsäure:
Monogerman kann auch durch direkte Reaktion von Germanium mit Wasserstoff dargestellt werden, wobei auch andere Germaniumhydride (Germane) wie Germaniumhexahydrid/Digerman (Ge2H6) und Germaniumoctahydrid/Trigerman (Ge3H8) entstehen. Leichter und mit hoher Reinheit gelingt die Synthese von Monogerman durch die Reaktion von Germaniumtetrachlorid mit Methan und Palladium als Katalysator. Die Ausbeute beträgt dabei 98 %, als Nebenprodukt entsteht Tetrachlormethan: Im Labormaßstab kann Monogerman auch durch Reaktion von Germanium(IV)-Verbindungen mit Hydriden gewonnen werden. Eine typische Synthese dieser Art ist Na2GeO3 mit Natriumborhydrid EigenschaftenMonogerman hat eine kritische Temperatur von 34,85 °C, einen kritischer Druck von 55,5 Bar und eine kritische Dichte von 0,598 kg/l. VerwendungMonogerman wird in der Elektronik-Industrie zur Epitaxie und zum Dotieren verwendet. SicherheitshinweiseSchon ab einem Anteil von ca. 10,1 % bildet Monogerman stark explosionsfähige Gemische mit Luft. Da das Gas sehr schwer ist und sich normalerweise nur bis zu 5 % in der Luft anreichert, ist es nur als hochentzündlich einzustufen. Monogerman ist sehr giftig. Bei einer akuten Vergiftung mit großen Mengen Monogerman treten die folgenden Symptome auf:
Ursache hierfür ist die Unterbrechung des Sauerstofftransports, da Monogerman mit dem im Blut transportierten Sauerstoff zu Germaniumoxid und Wasser reagiert: Verhindert werden kann dies durch Gabe von Komplexbildnern wie beispielsweise EDTA. Quellen
Kategorien: Feuergefährlicher Stoff | Giftiger Stoff | Germaniumverbindung | Wasserstoffverbindung |
||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Monogerman aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||







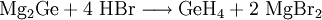 .
.