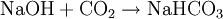Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
NatronlaugeNatronlauge ist die Bezeichnung für Lösungen von Natriumhydroxid (NaOH) in Wasser. Bei diesen Lösungen handelt es sich um alkalische Lösungen. Das Natriumhydroxid löst sich unter starker Wärmebildung sehr gut in Wasser. Eine bei Raumtemperatur gesättigte wässrige Lösung enthält pro Liter 1260 g Natriumhydroxid. Natronlauge ist eine der am häufigsten verwendeten Labor- und Industriechemikalien. Konzentrierte Natronlauge wirkt auf der Haut stark ätzend und selbst stark verdünnte Natronlauge kann die Hornhaut der Augen so schädigen, dass es zur Erblindung kommt. Einmolare Natronlauge (eine Lösung, die ein Mol NaOH (40 g) in einem Liter enthält; entspricht etwa 3,9 Gew.%) hat einen pH-Wert von 14. Die Basenstärke beträgt pKb = −2,43.
Produkt-Highlight
GewinnungNatronlauge wird meistens durch Elektrolyse aus Natriumchlorid gewonnen (zu etwa 65 Prozent der Weltproduktion). Dabei wird auch Chlor produziert. Der große Bedarf der chemischen Industrie an Natronlauge hat maßgeblich zur Entwicklung der Chlorchemie beigetragen (Beispiel: Polyvinylchlorid als Weiterverwendung des Chlors). Verwendung
AufbewahrungNatronlauge sollte nie in Gefäßen mit Glasschliffstopfen aufbewahrt werden. Mit dem Kohlenstoffdioxid aus der Luft bildet sich am Schliff Natriumhydrogencarbonat. Diese Salzkruste verklebt den Schliff mit der Hülse. Stattdessen empfiehlt sich ein Kunststoffbehälter aus z. B. PE-HD mit Schraubverschluss oder Gummistopfen. EntsorgungDa Natronlauge selbst sehr oft dazu verwendet wird, andere, für die Umwelt sehr gefährliche Chemikalien zu binden, ist nichts dagegen einzuwenden, nicht verunreinigte Natronlauge ausreichend verdünnt in die Kanalisation einzuleiten, sofern das Abwasser einer Kläranlage zugeführt wird. Kategorien: Chemische Lösung | Base |
|||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Natronlauge aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |