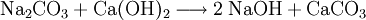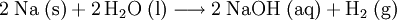Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Natriumhydroxid
Natriumhydroxid (auch Ätznatron, kaustische(s) Soda), chemische Formel NaOH, ist ein weißer hygroskopischer Feststoff. In Wasser löst es sich unter großer Wärmeentwicklung zur stark alkalisch reagierenden Natronlauge auf (pH ca. 14 bei c = 1 mol/l). Mit dem Kohlenstoffdioxid der Luft reagiert es zu Natriumcarbonat und wird deshalb in luftdicht verschlossenen Behältern aufbewahrt. Um zu verhindern, dass das Natriumhydroxid Wasser aus der Luft bindet, kann man es gemeinsam mit einem Trockenmittel lagern. Als starke Base verdrängt es schwächere und flüchtige Basen aus ihren Salzen. Die Weltproduktion lag im Jahre 2001 bei 46 Millionen Tonnen. Produkt-Highlight
Herstellung
Das wenig lösliche Calciumcarbonat wird abfiltriert. Im Filtrat verbleibt das gut lösliche Natriumhydroxid.
Es existieren mehrere industrielle Verfahren: (siehe auch Chlor-Alkali-Elektrolyse) Allen Verfahren gemein sind zusätzliche Reinigungs- und Aufkonzentrierungsstufen, um zu wasserfreiem Natriumhydroxid zu gelangen.
Verwendung
VersuchsbeispielWenn man ein wenig Natriumhydroxid in Wasser gibt und es dann verrührt, erwärmt sich die Lösung. Dies eignet sich als einfaches Beispiel für einen exothermen Lösungsvorgang, das beispielsweise in der Schule angewandt wird. Den gegenteiligen Effekt, einen endothermen Lösungsvorgang, kann man beobachten, wenn man Kaliumnitrat oder Ammoniumnitrat in Wasser löst, wobei der Effekt beim Lösen von Ammoniumnitrat wesentlich stärker ist (Temperaturabnahme von ca. 10 K). Quellen
Siehe auchKategorien: Ätzender Stoff | Hydroxid | Natriumverbindung |
|||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Natriumhydroxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||