Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Orbital
Da die Aufenthaltswahrscheinlichkeit der Elektronen mit dem Abstand vom Atomkern asymptotisch gegen null geht und sich bis ins Unendliche erstreckt, wählt man als Orbital den Aufenthaltsraum, in dem sich das betrachtete Elektron mit ca. 90 % Wahrscheinlichkeit aufhält. Man erhält damit Räume, die ungefähr der Größe der Atome entsprechen. Die Begrenzungsflächen sind Flächen gleicher Aufenthaltswahrscheinlichkeit (Isoflächen). Die Abstände der größten Wahrscheinlichkeiten innerhalb der Orbitale, ein Elektron anzutreffen, entsprechen den von Niels Bohr errechneten Bahnabständen. Die direkte Interpretation von Orbitalen als Wellenfunktionen ist nur bei Einzelelektronensystemen möglich. Bei Mehrelektronensystemen werden aber Orbitale in Slater-Determinanten eingesetzt um Mehrelektronen-Wellenfunktionen zu konstruieren. Solche Orbitale können durch Hartree-Fock-, Kohn-Sham-Rechnungen (siehe: Dichtefunktionaltheorie (Quantenphysik)) oder MCSCF-Rechnungen (MCSCF: Multiconfiguration Self Consistent Field) bestimmt werden, sind aber im Regelfall nicht eindeutig definiert (verschiedene Orbitalsätze repräsentieren die gleiche Mehrteilchen-Wellenfunktion). Produkt-Highlight
KlassifikationOrbitale werden anhand der vier Quantenzahlen n, l, ml und s klassifiziert, manchmal auch durch n, l, j und mj, wobei gilt:
Oft wird der Bahndrehimpuls und der Spin zum Gesamtdrehimpuls eines Elektrons mit der Quantenzahl j addiert (Wertebereich |l - s|, |l - s| + 1, ..., l + s), die zugehörige magnetische Quantenzahl ist dann mj. Charakteristische FormenDie Orbitale zu den verschiedenen l Zahlen haben charakteristische (grobe) Formen, die auch bei höheren n-Werten qualitativ erhalten bleiben. Jedem l wird aus historischen Gründen ein bestimmter Buchstabe zugeteilt:
(Die Bezeichnungen s, p, d und f stammen aus der Spektroskopie und dienen nur der Bezeichnung. Ein g-Orbital mit l = 4 tritt theoretisch für ein Atom mit der Ordnungsnummer 121 auf. Die Bezeichnung folgt wie auch beim nachfolgenden h-Orbital (l = 5) dem Alphabet.) Die Orbitale charakterisieren streng genommen nur die möglichen Eigenzustände der Elektronen-Wellen, wie sie in Einelektronensystemen, wie z.B. Wasserstoffatom H oder Heliumionen He+, Lithiumionen Li+ usw. vorkommen. Die zu den Orbitalen gehörigen Wellenfunktionen (siehe auch Kugelflächenfunktionen) ergeben sich aus der stationären Schrödingergleichung eines Einelektronensystems. Trotz dieser Einschränkung reicht allerdings die Kenntnis der groben Form der Orbitale, die auch in Mehrelektronensystemen erhalten bleibt, um viele qualitative Fragen zum Aufbau von Stoffen zu beantworten. Es ist dabei zu beachten, dass die in der Literatur dargestellten Orbitale oft nicht die Eigenzustände des Drehimpulsoperators sind. Zum Beispiel wird von den Eigenzuständen von Lz (Drehimpuls in z-Richtung) nur der eine Eigenzustand für den Eigenwert m = 0 dargestellt und als pz bezeichnet. Die mit px und py bezeichneten Orbitale sind nicht die entsprechenden Eigenzustände für m = -1 und m = 1 sondern Superpositionen dieser Eigenzustände. (Sie sind Eigenzustände von Lx bzw. Ly , die aber nicht mit Lz kommutieren!) Für die Schlussfolgerungen ist das kein Problem, solange die entsprechenden Wellenfunktionen orthogonal sind. QuantentheorieAus der nichtrelativistischen Quantentheorie ergeben sich die Orbitale nach folgender Rechnung: Die Wechselwirkung zwischen Elektron und Atomkern wird vereinfacht durch das Coulombpotential beschrieben, der Atomkern wird als fix angenommen. Der Hamiltonoperator für das Einelektronensystem ist 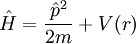 Da der Hamiltonoperator mit dem Drehimpulsoperator kommutiert, bilden H, L2 und Lz ein vollständiges System kommutierender Operatoren. Es gibt also gemeinsame Eigenzustände dieser drei Operatoren. Die Zustände sind durch die drei zugehörigen Quantenzahlen n, l und m bestimmt. Die Schrödingergleichung lässt sich in einen radiusabhängigen und einen winkelabhängigen Teil zerlegen. Die Eigenfunktionen sind das Produkt aus Kugelfunktionen (Eigenfunktionen des Drehimpulsoperators) HybridisierungEinige Symmetrien von chemischen Bindungen scheinen den charakteristischen Formen der Orbitale zu widersprechen. Diese Bindungssymmetrien werden erst durch die Bildung von Hybrid-Orbitalen verständlich. Dabei handelt es sich um Orbitale, die in Mehrteilchenwellenfunktionen auftreten (siehe oben). Siehe auchKategorien: Atomphysik | Physikalische Chemie | Theoretische Chemie |
|||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Orbital aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


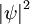 wird als
wird als 


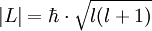
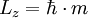
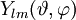 und einem radialen Anteil
und einem radialen Anteil 

