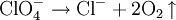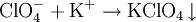Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
PerchlorateAls Perchlorate werden die Salze der Perchlorsäure HClO4 bezeichnet. Das Perchlorat-Ion ist ein einfach negativ geladenes Ion mit tetraedrischer Symmetrie: ClO4−. Das Zentralatom ist formell ein Cl7+-Ion mit 4 Sauerstoff-O2−-Liganden. Produkt-HighlightPerchlorate sind Oxidationsmittel und geben beim Erhitzen Sauerstoff ab: Die meisten Perchlorate sind leicht löslich. Eine Ausnahme ist das Kaliumperchlorat, das nur mäßig löslich ist. Kaliumsalze können daher durch die Bildung eines weißen Niederschlages mit Hilfe von Perchlorat nachgewiesen werden: In wässriger Lösung wirken Perchlorate kaum oxidierend, da ihre Reduktion in Lösungen ohne Katalysator sehr langsam erfolgt. Sie sind brandfördernd und werden in der Pyrotechnik und in Sprengstoffen verwendet. In Raumstationen (wie der ISS) werden Perchlorat-Kartuschen genutzt, um im Notfall schnell Sauerstoff produzieren zu können. BeispieleLithiumperchlorat LiClO4, Kaliumperchlorat KClO4, Ammoniumperchlorat, Magnesiumperchlorat, Silberperchlorat. Siehe auchKategorien: Stoffgruppe | Perchlorat |
| Dieser Artikel basiert auf dem Artikel Perchlorate aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |