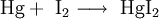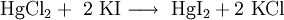Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Quecksilber(II)-iodid
Quecksilber(II)-iodid ist eine chemische Verbindung und gehört zu den Halogeniden des Schwermetalls Quecksilber. Direkten Kontakt mit Quecksilberiodid sollte man wegen seiner hohen Toxizität meiden. Quecksilberiodid ist ein Halbleiter und lichtempfindlich. Mit Kaliumiodid und Quecksilberchlorid bildet es kristallisierbare Doppelverbindungen. Produkt-Highlight
EigenschaftenQuecksilberiodid ist ein scharlachrotes, schweres, mikrokristallines Pulver, das sich beim Erhitzen bis zum Schmelzpunkt bei 259 °C gelb verfärbt.[2] Es ist für die meisten lebenden Organismen giftig und verhält sich ähnlich wie das Quecksilber(II)-chlorid. Für salzartige Verbindungen hat Quecksilberiodid mit 354 °C einen sehr niedrigen Siedepunkt. Gewinnung und DarstellungQuecksilberiodid kann direkt aus den Elementen Quecksilber und Iod dargestellt werden: Auch bei Zugabe von Quecksilber(II)-chlorid zu einer wässrigen Lösung von Kaliumiodid entsteht Quecksilberiodid als roter Niederschlag: VerwendungQuecksilberiodid findet Verwendung in der Neßler-Reaktion. Außerdem wird es in der Tiermedizin auch als Tinktur für Verletzungen verwendet.[3] Siehe auch
Quellen
Kategorien: Giftiger Stoff | Umweltgefährlicher Stoff | Quecksilberverbindung | Iodid |
||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Quecksilber(II)-iodid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||