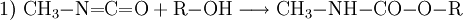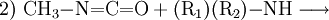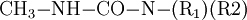Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Methylisocyanat
Methylisocyanat (kurz MIC) ist der einfachste Ester der Isocyansäure. Es ist eine sehr reaktive chemische Verbindung, die z. B. bei der Herstellung von Insektiziden verwendet wird. Wie die Isocyansäure und die anderen Isocyanate ist es hochgiftig. Im indischen Bhopal gab es einen schweren Chemieunfall mit Methylisocyanat. Weiteres empfehlenswertes Fachwissen
GeschichteAm 3. Dezember 1984 entwichen beim so genannten Bhopalunglück aus einem defekten Tank einer Pestizidfabrik des amerikanischen Chemiekonzerns Union Carbide Corporation in der Nähe der Stadt Bhopal (Indien) über 40 Tonnen Methylisocyanat. Gewinnung und DarstellungTechnisch wird Methylisocyanat durch Reaktion von Methylamin und Phosgen hergestellt. Nach Abspaltung von Chlorwasserstoff (HCl) wird das Zwischenprodukt Carbamoylchlorid in Methylisocyanat umgewandelt:
Methylamin reagiert im ersten Schritt bei −20 °C bis 60 °C mit Phosgen unter HCl-Abspaltung zu Carbamoylchlorid. Im zweiten Schritt bei 100–200 °C entsteht unter erneuter Eliminierung von HCl Methylisocyanat. EigenschaftenMethylisocyanat ist eine flüchtige, farblose Flüssigkeit, die stark Tränenerregend ist. Sie hat einen stechenden Geruch wenn sie konzentriert ist. Sie ist leichtentflammbar (Flammpunkt bei −7 °C). Bei leicht erhöhten Temperaturen (38 °C) geht sie in den gasförmigen Aggregatzustand über. Das Gas ist schwerer als Luft und bildet mit dieser leicht explosive Gemische (Explosionsgrenzen: 5,3–26 Volumenprozent Methylisocyanat). Gasförmiges Methylisocyanat entzündet sich selbsttätig bei 535 °C. VerwendungMethylisocyanat wird vor allem zur Herstellung von Carbamaten durch Umsetzung mit einem Alkohol (1) oder zur Herstellung von speziellen Harnstoffen durch Umsetzung mit Aminen (2) verwendet: In der Pestizidfabrik des amerikanischen Chemiekonzerns Union Carbide Corporation in der Nähe der Stadt Bhopal wurden seinerzeit die Wirkstoffe Carbaryl (1-Naphthol,N-methylcarbamate, CAS Nr. 63-25-2) und Aldicarb (2-Methyl-2-(methylthio)propionaldehyde O-methylcarbamoyloxime, CAS Nr. 116-06-3) produziert. PhysiologieDie direkte Toxizität von Methylisocyanat resultiert aus der Fähigkeit, zahlreiche nukleophile Gruppen stoffwechselaktiver Biomoleküle anzugreifen. Der Mechanismus für den Transport wurde 1992 entdeckt. Demnach kann Glutathion, ein Tripeptid, dessen Aufgabe es eigentlich ist, den Organismus vor der Schädigung durch toxische Substanzen zu schützen, Methylisocyanat reversibel an die Thiolgruppe addieren und damit im Körper transportieren. SicherheitshinweiseToxizitätMethylisocyanat verursacht bei Exposition Verätzungen der Schleimhäute, Augen und Lungen, jedoch wurden bei Opfern des Bhopalunglücks vielfach auch schwere Verätzungen innerer Organe festgestellt. Dieser Befund war insofern überraschend, als Methylisocyanat zu reaktiv ist, um unverändert in den Kreislauf zu gelangen. Kategorien: Feuergefährlicher Stoff | Giftiger Stoff | Chemische Verbindung |
||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Methylisocyanat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||