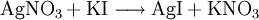Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Silberiodid
Silberiodid (auch Silberjodid) ist eine chemische Verbindung aus Silber und Iod. Es ist ein gelbliches, in Wasser unlösliches Salz. Produkt-Highlight
VorkommenNatürlich kommt Silberiodid als Mineral Jodargyrit vor. Gewinnung und Darstellung
Silberiodid wird durch Ausfällen aus einer Silbernitrat-Lösung mit Hilfe von Kaliumiodid gewonnen. Diese Reaktion wird auch in der chemischen Analytik als Nachweis für Iodid-Ionen benutzt, weil das entstehende AgI einen schwerlöslichen gelblichen Niederschlag bildet. Im Gegensatz zum Silberiodid lassen sich das ebenfalls schwer lösliche Silberchlorid (AgCl) und Silberbromid (AgBr) in verdünntem bzw. konzentriertem Ammoniakwasser als Silberdiamminkomplexe lösen (Komplexbildungsreaktion). Chlorid-, Bromid- und Iodid-Ionen können so mit Hilfe von Silbernitratlösung und Ammoniak voneinander unterschieden werden. EigenschaftenPhysikalische EigenschaftenVon Silberiodid sind mehrere Modifikationen bekannt[2]. Bei Raumtemperatur ist das β-AgI thermodynamisch stabil, das in der Wurtzit-Struktur kristallisiert. Daneben existiert eine metastabile Modifikation, das γ-AgI, das eine Zinkblende-Struktur hat. Oberhalb von etwa 147°C ist das α-AgI stabil, das aufgrund seiner hohen Silberionen-Leitfähigkeit zu den festen Ionenleitern gehört. Seine ionische Leitfähigkeit liegt in der Größenordnung von 1 bis 2 S/cm [3]. Das α-AgI hat ein kubisch-innenzentriertes Iodid-Untergitter und ein strukturell fehlgeordnetes Silberionen-Untergitter. Die Silberionen können sich also zwischen den größeren Iodidionen frei bewegen. Durch Einlagerung von Rubidium-Ionen zum Rubidiumsilberiodid (Ag4RbI5) kann die Temperatur des α/β-Phasenüberganges auf unter Raumtemperatur gesenkt werden. Dadurch wird auch der Bereich der Ionenleitung bis auf Raumtemperatur ausgedehnt. Die elektronische Leitfähigkeit von α-AgI beruht auf Lochleitung und ist proportional zum I2-Partialdruck. Sie ist gegenüber der Ionenleitfähigkeit um ungefähr den Faktor 1010 kleiner[4]. Dies macht Silberiodid als festen Elektrolyten besonders gut geeignet. Chemische EigenschaftenSilberiodid ist lichtempfindlich und zerfällt dabei langsam in die Elemente. An Sonnenlicht verfärbt es sich grün-grau. AgI löst sich in starken Komplexbildnern, wie Cyaniden oder Thiocyanaten. VerwendungSilberiodid wird mit Aceton gemischt aus Hagelfliegern versprüht, um in der Atmosphäre kleinste Kondensationskerne zur gezielten Regen- oder Hagelbildung zu erzeugen. Damit kann die Bildung von zu großen Hagelkörnern verhindert werden. In den Anfangszeiten der Fotografie im 19. Jahrhundert wurde es wegen seiner Lichtempfindlichkeit für verschiedene Edeldruckverfahren wie Talbotypie, Kalotypie und Argyrotypie verwendet. Später wurde es durch besser geeignete Substanzen wie Silberbromid ersetzt. Außerdem dient es dazu, Trinkwasser zu sterilisieren, wobei auf Grund seiner toxischen Wirkung ein bestimmter Grenzwert nicht überschritten werden darf. Quellen
Kategorien: Iodid | Silberverbindung |
|||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Silberiodid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||