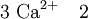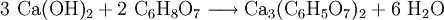Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Calciumcitrat
Calciumcitrat (Tricalcium-di-[2-hydroxy-1,2,3-propantricarboxylat]-Tetrahydrat), ein Salz der Citronensäure, ist ein weißer, geruchloser, geschmacksneutraler, kristalliner Feststoff. Produkt-Highlight
Gewinnung und DarstellungDie Herstellung erfolgt durch Neutralisation von Citronensäure mittels einer Calciumquelle wie Calciumhydroxid. Bei dieser exothermen Fällungsreaktion werden pro Teil Calciumcitrat vier Moleküle Wasser („Kristallwasser“) gebunden.
EigenschaftenDer Calciumgehalt beträgt 21 %. Die Wasserlöslichkeit steigt mit sinkender Temperatur (inverse Löslichkeit) und sinkendem pH-Wert. Aufgrund der organischen Citronensäure und der damit verbundenen höheren Löslichkeit ist die Bioverfügbarkeit des enthaltenen Calciums höher als bei den anorganischen Calciumsalzen wie Calciumcarbonat, Calciumphosphat. VerwendungNeben dem lange bekannten positiven Einfluss von Calcium auf die Knochendichte (s. Osteoporose), zeigen neuere Untersuchungen, dass bei einer ausreichenden Calciumzufuhr auch das Risiko für Übergewicht und Fettleibigkeit sinkt. Aus diesen Gründen wird Calciumcitrat Nahrungsmitteln zur Calciumanreicherung zugesetzt und für Nahrungsergänzungsmittel (Functional Food) verwendet. Es wird aber auch als Säureregulator und Stabilisator und in Arznei-, Futter- und Zahnpflegemitteln eingesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 333 zugelassen. QuellenLiteratur und Weblinks
Kategorien: Calciumverbindung | Citrat | Lebensmittelchemie | Arzneistoff |
|||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Calciumcitrat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||