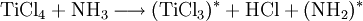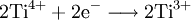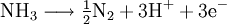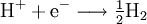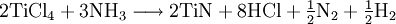Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
GasphasenammonolyseProdukt-HighlightDefinitionGasphasenammonolyse bedeutet die Umsetzung von Ammoniak (chemische Reaktion) in der Gasphase, d.h. alle Edukte werden in einem Reaktor in der Gasphasen zu den entsprechenden Produkten mit Ammoniak umgesetzt. Somit ist der Temperaturbereich dieser Variante festgelegt durch die Siedepunkte der Edukte und der Stabilität der Produkte bei den unterschiedlichen Temperaturen. MechanismusIn der Regel werden chemisch reaktive Metallverbindungen eingesetzt. Dabei dienen häufig Chloride als Edukt für die Umsetzung mit Ammoniak. Nach Möglichkeit ist dieses leicht erhältlich und ohne größere Probleme genau in den Reaktor einzuleiten. Im Falle des Titannitrids wird Titantetrachlorid als flüssiges Reagenz mittels einer Schlauchpumpe in den Reaktor geleitet. Der Ammoniak wird als Gas dazugegeben. Flüssiges Titantetrachlorid geht in die Gasphase über und kann mit Ammoniak vermischt werden. So wird ein homogenes Gemisch an pulverförmigen Produkten erreicht, die im Idealfall rein sind. Dabei entstehen je nach Temperatur der durchgeführten Gasphasenammonolyse unterschiedliche Reaktionsprodukte. Das Chlor an dem Titan ist das aktive Zentrum für die Reaktion. Chlorid als elektronegativer Partner behält seine gesamten 8 Außenelektronen und geht mit dem aciden Wasserstoff vom Ammoniak ein Bindung ein. So entsteht Chlorwasserstoff, was als Triebkraft der Reaktion angesehen werden kann. In diesem Beispiel wird Titantetrachlorid als Edukt verwendet. Titan wird während der Reaktion vom 4wertigen positiven Zustand zum 3wertigen positiven Zustand reduziert. Die entsprechende Oxidation geht vom Stickstoff im Ammoniak aus. Dieser ist im Ammoniak im 3wertigen negativen Zustand und wird zum Stickstoff oxidiert, der weder positiv, noch negativ geladen ist. Insofern müssen wenigstens 2 Ammoniakmoleküle mit einem Titantetrachloridmolekül reagieren. Die so frei werdenden Elektronen reduzieren nicht nur den Ammoniak, sondern auch den Wasserstoff aus dem Molekül Ammoniak. Insofern ist die Gasphasenreaktion eine Redoxreaktion. Teilreaktionen:
Zusammengefasst ergibt dies folgende Gesamtreaktion: Je nach Temperaturbereich werden unterschiedliche Produkte erhalten, die neben Stickstoff das positive (Halb-)Metall, Chlorid und Wasserstoff enthalten. Dies ist allerdings nur ein Beispiel für die zahlreichen Möglichkeiten, Ammoniak in der Gasphase umzusetzen. Wichtige Reaktionsprodukte sind ebenfalls die Nitride der (Halb-)Metalle Aluminium, Bor, Molybdän, Silicium, Wolfram u.a.! Daneben existieren eine Reihe weiterer Varianten hinsichtlich der Abwandlung der Reaktionsgemische. So können beispielsweise Sauerstoff oder auch Wasser dem System zugeführt werden, um Oxidnitride zu erhalten. Insofern ist der Gasphasenammonolyse an Variantenreichtum noch lange kein Ende gesetzt. Literatur[1] Šingliar, U.: Dissertation, TU Bergakademie Freiberg, 2002 [2] Pätzold, C.: Dissertation, TU Bergakademie Freiberg, 2001 |
| Dieser Artikel basiert auf dem Artikel Gasphasenammonolyse aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |