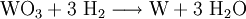Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Wolfram
Das Metall Wolfram [ˈvɔlfram] (engl. Tungsten) ist ein chemisches Element mit dem Symbol W und der Ordnungszahl 74. Es ist ein weißglänzendes Schwermetall, das zu den Übergangsmetallen gezählt wird. Wolfram besitzt von allen reinen Metallen den höchsten Schmelz- und Siedepunkt. Produkt-Highlight
GeschichteBereits im 16. Jahrhundert beschrieb der Freiberger Mineraloge Georgius Agricola das Vorkommen eines Minerals in sächsischen Zinnerzen, welches die Zinngewinnung durch Verschlackung des Zinnanteils erheblich erschwerte. Ob es sich dabei um Wolframit handelte, ist auch heute noch umstritten, da er von der „Leichtigkeit“ des Minerals sprach. Er nannte das Mineral lupi spuma, was aus dem Lateinischen übersetzt soviel wie „Wolf(s)-Schaum“ bedeutet. Später wurde aus Wolfschaum Wolfrahm. Und schließlich entstand das heute bekannte Wort Wolfram. Das im Englischen und Französischen gebräuchliche Wort Tungsten, leitet sich von Tung Sten (Calciumwolframat) (schwedisch für „schwerer Stein“) ab. In diesem erkannte 1781 der schwedische Chemiker Carl Wilhelm Scheele ein bis dahin unbekanntes Salz. Reines Wolfram wurde erstmals 1783 von den spanischen Brüdern Fausto und Juan José Elhuyar (die unter der Leitung von Scheele arbeiteten) durch Reduktion von Wolframtrioxid, welches man aus Wolframit gewinnt, hergestellt. VorkommenWolfram ist an der Erdkruste mit einem Gehalt von etwa 1 · 10−5 %[2] beteiligt. Das Metall kommt in der Natur nicht gediegen vor. Es sind einige Minerale, vor allem Oxide und Wolframate bekannt. Die wichtigsten Wolframerze sind Wolframit (Mn, Fe)WO4 und Scheelit CaWO4. Daneben gibt es weitere Wolframminerale, wie Stolzit PbWO4 und Tuneptit WO3 · H2O. Die größten Lagerstätten findet man in China, den USA, Korea, Bolivien, Kasachstan, Russland, Österreich und Portugal. Auch im Erzgebirge findet man Wolframerze. Die sicheren und wahrscheinlichen Weltvorkommen betragen derzeit 2,9 Mio. Tonnen reines Wolfram. Das bedeutendste bekannte Vorkommen von Wolfram in Europa befindet sich im Felbertal in den Hohen Tauern (Bundesland Salzburg). Die Staaten mit der größten FörderungDie Staaten mit der größten Förderung von Wolfram (2006)[3]
2006 betrug die Weltproduktion von reinem Wolfram 73.300 Tonnen)[3]. Der mit Abstand größte Produzent an Wolfram ist China. Mehr als 80 % des auf der Welt produzierten Wolframs wird dort hergestellt. In Österreich wurde Scheelit erstmals schon 1815/16 auf der Goldlagerstätte Schellgaden im Lungau (Salzburg) entdeckt. In der Folge fand man in vielen Klüften der Hohen Tauern schöne, mitunter mehrere Zentimeter große Scheelitkristalle. Diese Funde waren allesamt von keinem praktischen Nutzen. Die große Lagerstätte im Felbertal blieb vorerst unentdeckt. 1950 wurde bekannt, dass in der bereits seit 1927 im Abbau befindlichen Magnesitlagerstätte auf der Wanglalm bei Lanersbach/Tux (Tirol) im hinteren Zillertal Scheelit in größeren Mengen auftrat. Es handelte sich dabei um derben, mit Magnesit und Quarz verwachsenen Scheelit. In den folgenden Jahren wurden jeweils etwa 10.000 Tonnen Erz mit einem Wolframoxidgehalt von durchschnittlich 1,8 % gewonnen, was eine weltweit einmalig hohe Qualität darstellte. Wegen des niedrigen Marktpreises wurde die Wolframgewinnung jedoch Ende der 1960er-Jahre eingestellt, aber 1971 wieder aufgenommen und bis zur Schließung des Magnesitbergbaues 1976 weiter geführt. 1967 wurde schließlich das bislang größte Scheelitvorkommen Europas im Felbertal entdeckt. Den in Bächen vorhandenen Erzstücken wurde dabei mit Hilfe von UV-Licht nachgespürt (Scheelit fluoresziert dabei). Die schwierigen Explorationsarbeiten im hochalpinen Gelände (höchste Abbaustelle am Brentling in 2100 m Seehöhe) begannen 1971, der vorerst übertägige Bergbau wurde im Felbertal 1976 aufgenommen (ab 1979 auch Untertagebergbau, Übertagebergbau 1986 eingestellt). Von Anfang 1993 bis Mitte 1995 war der Bergbau wegen des niedrigen Marktpreises für Wolfram vorübergehend eingestellt. Die Aufbereitung des Wolframerzes aus dem Felbertal erfolgt im nahen Mittersill. Von hier gelangt das Scheelitkonzentrat nach Sankt Martin im Sulmtal (Steiermark). Auf dem Gelände der 1976 geschlossenen Untertage-Braunkohlengrube von Pölfing-Bergla entstand eine Wolframhütte, in der seit 1977 aus Konzentraten aus mehreren Ländern Wolframoxid-, Wolframmetall- und Wolframcarbidpulver hergestellt werden. Bedeutendste deutsche Verarbeiter sind H.C. Starck und die Longyear GmbH. Gewinnung und DarstellungWolfram kann nicht durch Reduktion mit Kohle aus den oxidischen Erzen gewonnen werden, da hierbei Wolframcarbid entsteht. Die Wolframerze werden zunächst durch Flotation angereichert. Danach erfolgt der Aufschluss der gemahlenen Erze durch Schmelzen mit Soda bei ca. 800 °C oder mit Natronlauge unter Druck (Rösten), wobei zunächst lösliches Natriumwolframat entsteht. Nach dem Ausfällen und Abfiltrieren von Verunreinigungen wird das Natriumwolframat (Na2WO4 · 2 H2O) mit Calciumchlorid zu Calciumwolframat umgewandelt, das mit Salzsäure zu Wolframsäure (WO3*H2O) reagiert, welche abfiltriert wird. Durch Zusatz ammoniakalischer Lösung entsteht ein Komplex namens Ammonium-Parawolframat (APW). Dieser wird ebenfalls abfiltriert und anschließend bei 600 °C in relativ reines Wolframtrioxid überführt. Durch Glühen erhält man Wolfram(VI)-oxid (WO3), das bei 800 °C unter Wasserstoffatmosphäre zu stahlgrauem Wolfram reduziert wird: Dabei entsteht graues Wolframpulver,dieses wird meist in Formen verdichtet und elektrisch zu Barren gesintert. Bei Temperaturen über 3400 °C kann in speziellen Elektroöfen mit reduzierender Wasserstoffatmosphäre ein kompaktes Wolframmetall erschmolzen werden (Zonenschmelzverfahren). EigenschaftenPhysikalische EigenschaftenEs ist ein weißglänzendes, dehnbares Metall hoher Dichte – etwa gleich hoch wie Gold – Härte (Brinellhärte von 250 HB) und Festigkeit (Zugfestigkeit von 4200 N/mm2). Das Metall existiert in einer stabilen kubisch-raumzentriert Alpha-Modifikation. Dieser Kristallstrukturtyp wird häufig nach Wolfram Wolfram-Typ genannt. Die metastabile Beta-Modifikation (verzerrt kubisch-raumzentriert) stellt in Wahrheit ein Wolfram(VI)-oxid dar. Wolfram besitzt nach dem Kohlenstoff den höchsten Schmelzpunkt aller chemischen Elemente. Das Metall ist ein Supraleiter mit einer Sprungtemperatur von 0,015 K[4]. Chemische EigenschaftenWolfram ist ein chemisch sehr widerstandsfähiges Metall, das selbst von Fluorwasserstoffsäure und Königswasser (zumindest bei Zimmertemperatur) kaum angegriffen wird. Es löst sich aber in Gemischen aus Fluss- und Salpetersäure und geschmolzenen Gemischen aus Alkalinitraten und -karbonaten auf. IsotopeIn der Natur kommt Wolfram in 5 Isotopen mit den Massenzahlen 180, 182, 183, 184 und 186 vor, wobei die Massenzahl 184 die größte Häufigkeit aufweist. Erst 2004 gelang dem CRESST Experiment am Laboratori nazionali del Gran Sasso der Nachweis, dass das Isotop mit der Massenzahl 180 dem Alphazerfall unterliegt,[5] mit der extrem langen Halbwertszeit von 1,8 Trillionen Jahren. Die Radioaktivität ist so gering, dass sie für alle praktischen Zwecke ignoriert werden kann. VerwendungWolfram findet wegen seines hohen Schmelzpunktes in der Leuchtmittelindustrie als Glühwendel in Glühlampen und als Elektrode in Bogenlampen und in Elektronenröhren Verwendung. Seine zweite große Bedeutung hat es als Legierungsmetall in der Eisenmetallurgie. Es macht den Stahl widerstandsfähig. Auf Grund seiner hohen Dichte wird es für Ausgleichsgewichte und zur Strahlungsabschirmung verwendet, und in einigen Armeen wird panzerbrechende Munition mit einem Projektilkern aus Wolframkarbid anstelle des billigeren, aber radioaktiven abgereicherten Urans verwendet. Im Zweiten Weltkrieg war Wolfram wichtig für den Bau deutscher Hochleistungsgeschütze, etwa der Panzerkanone des Panther. In Zukunft soll Munition mit Wolframkern vom neuen Schützenpanzer Puma benutzt werden, der den Marder ablösen soll. Darüber hinaus wird Wolfram in Form von Wolframkarbid als Neutronenreflektor bei Kernwaffen eingesetzt, um die kritische Masse herabzusetzen. Wegen seiner hohen Korrosionsbeständigkeit kann Wolfram auch als Werkstoff für Apparaturen in chemischen Anlagen verwendet werden. Allerdings wird diese Anwendungsform wegen der schlechten Bearbeitbarkeit von Wolfram (Wolfram kann nur mit Laser- oder Elektronstrahl geschweißt werden) nur selten angewandt. Das Gleiche gilt auch für eine denkbare Anwendung als Wolframschmuck oder im Bereich der Medizintechnik. In der Physiologie, besonders der Neurophysiologie, werden Mikroelektroden aus Wolfram für extrazelluläre Ableitungen verwendet. Wolframkarbide (Hartmetall) werden aufgrund ihrer hohen Härte in der Materialbearbeitung verwendet. Wolframate werden zur Imprägnierung von Stoffen verwendet, um diese schwer entflammbar zu machen. Wolframhaltige Farben werden in der Malerei sowie in der Keramik- und Porzellanindustrie verwendet. Zudem werden Elektroden für den Widerstandsschweißprozess aus Wolfram hergestellt, insbesondere wenn Werkstoffe wie Kupfer, Bronze oder Messing geschweißt werden sollen. Im Sport kommt Wolfram zur Herstellung hochwertiger Barrels für das Dartspiel zum Einsatz, und beim Hammerwurf wurden Hammerköpfe zeitweise zur Reduktion des Luftwiderstandes und des Rotationsradius ebenfalls aus Wolfram gefertigt. Außerdem werden Wolframplatten als Zusatzgewichte in der Formel 1 verwendet, um das vorgeschriebene Mindestgewicht von Formel 1-Wagen (inkl. Öl-, Brems- und Kühlflüssigkeit, sowie Fahrer im Rennoverall und mit Helm) von 600 kg zu erreichen. Auch im Segelsport kommt es seit einiger Zeit in den Kielbomben großer Racer zum Einsatz. Dabei wird der Wasserwiderstand, durch die größere Dichte gegenüber herkömmlichen Materialien wie Blei oder Gusseisen, stark verringert. Saiten für Musikinstrumente werden zum Teil mit Wolfram umsponnen, um ihr Gewicht zu erhöhen und dadurch die Tonhöhe zu verringern. Wolfram findet auch in der Röntgendiagnostik als Targetmaterial in der Anode Verwendung. Die Kα- und Kβ-Linien der Charakteristischen Röntgenstrahlung liegen um 59 keV bzw. 67 keV. In der Rastertunnelmikroskopie wird Wolfram oft als Material für die Sondenspitze verwendet. Seit Anfang des 21. Jahrhunderts wird Wolfram auch zu Schmuck (Tungsten Schmuck), z. B. Ringen verarbeitet. PhysiologieNach dem derzeitigen Wissensstand gelten Wolfram und seine Verbindungen als physiologisch unbedenklich. Lungenkrebserkrankungen bei Arbeitern in Hartmetall-produzierenden oder verarbeitenden Betrieben werden auf das ebenfalls anwesende Cobalt zurückgeführt.[6] Im Tiermodell wurde festgestellt, dass die größte Menge an peroral aufgenommenen Wolfram-Verbindungen wieder rasch über den Urin ausgeschieden wird. Ein kleiner Teil des Wolframs geht in das Blutplasma und von dort in die Erythrozyten über. Danach wird es in den Nieren und im Knochensystem abgelagert. Drei Monate nach der Verabreichung wird der größte Anteil, des insgesamt nur in sehr kleiner Menge vom Körper aufgenommenen Wolframs, in den Knochen gefunden.[7] Es wird als positives Bioelement von anaeroben Bakterien des Typs Eubacterium acidaminophilum verwendet und als Cofaktor in einige Enzyme eingebaut. E. acidaminophilum ist ein Aminosäuren vergärendes Bakterium, welches Wolfram in den Enzymen Formiat-Dehydrogenase und Aldehyd-Dehydrogenase nutzt.[8][9] 2003 wurden in Fallon/Nevada mit 16 seit 1997 an Leukämie erkrankten Kindern und in Sierra Vista/Arizona mit 9 ebenfalls an Blutkrebs erkrankten Kindern, zwei sogenannte Krebscluster – das ist ein lokales Gebiet mit einer überdurchnittlich hohen Rate an Krebserkrankungen – identifiziert. In beiden Orten weist das Trinkwasser außergewöhnlich hohe Konzentrationen von Wolfram auf. Im Urin der Bevölkerung wurden deutlich erhöhte Wolframkonzentrationen nachgewiesen. Beide Orten sind für ihre Vorkommen von Wolfram-Erzen bekannt. [10][11] In den nachfolgenden, etwa ein Jahr dauernden Untersuchungen des Center of Desease Control (CDC) konnte allerdings kein direkter Zusammenhang zwischen Wolfram und den Leukämie-Erkrankung festgestellt werden. Wolfram zeige in keinem Testverfahren karzinogene Wirkungen und in anderen Orten Nevadas mit ähnlich hohen Wolframwerten im Urin der Bevölkerung, seien keine Krebscluster feststellbar.[12] SicherheitshinweiseAls Pulver oder Staub ist es leicht entzündlich, in kompakter Form nicht brennbar. Verbindungen
Abbildungen
Referenzen
Literatur
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Wolfram aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||