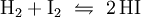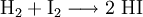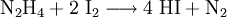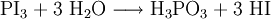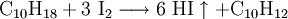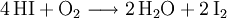Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Iodwasserstoff
Iodwasserstoff (Summenformel HI), auch als Wasserstoffiodid oder Hydrogeniodid bezeichnet, ist ein farbloses, stechend riechendes, giftiges Gas, das sich sehr gut in Wasser unter Bildung der starken Iodwasserstoffsäure löst. Produkt-Highlight
GeschichteDie Bildungs- und Zersetzungsreaktion: wurde bereits 1894 von dem Physiko-Chemiker Max Bodenstein eingehend und mit hoher Genauigkeit untersucht. Sie war Ende des 19. Jahrhunderts ins Blickfeld der Forscher geraten, weil sie eine Beobachtung molekularer Gleichgewichtsreaktionen ermöglichte. Neben der Knallgasreaktion und Bildung von Schwefeltrioxid bildete die Iodwasserstoffreaktion eine experimentelle Grundlage zu einer Theorie der Kinetik der Gasreaktionen. DarstellungIndustriell erfolgt die Herstellung durch katalytische Reaktion der gasförmigen Elemente über einen auf 500 °C erwärmten Platin-Schwamm als Katalysator:
Vereinzelt wird auch die Reaktion von Iod mit Hydrazin genutzt:
Darüber hinaus vermag Wasser aus Phosphortriiodid Iodwasserstoff freizusetzen: Diese Reaktion ist jedoch ungeeignet, um wirklich trockenen Iodwasserstoff auszutreiben. Als Laborsynthesen für Iodwasserstoff bieten sich folgende Möglichkeiten an: EigenschaftenUnter Luftabschluss ist es beständig. An Luft tritt Oxidation zu Iod ein: Oxidationsmittel wie Brom und Chlor oxidieren Iodwasserstoff unter Bildung des entsprechenden Halogenwasserstoffes zum elementaren Iod. Beim Erhitzen spaltet sich Iodwasserstoff in die Elemente Wasserstoff und Iod auf (Rückreaktion der Bildungsreaktion). VerwendungIodwasserstoff findet Verwendung zur Herstellung von Iodiden, organischen Iodverbindungen und als Katalysator. In der Analytik durch chemischen Abbau spielte er als Reduktionsmittel eine nicht unwesentliche Rolle. SicherheitshinweiseIodwasserstoff reizt die Atemwege. Quellen
Kategorien: Ätzender Stoff | Iodverbindung | Wasserstoffverbindung | Iodid |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Iodwasserstoff aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||