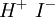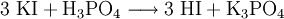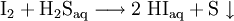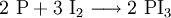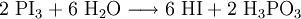Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Iodwasserstoffsäure
Produkt-HighlightDie wässrige Lösung von Iodwasserstoff (HI) reizt die Atemwege und verursacht schwere, schlecht heilende Verätzungen. Daher ist beim Umgang mit Iodwasserstoffsäure stets Vorsicht geboten. In den Handel kommt Iodwasserstoffsäure meist als 57 %ig Säure. SyntheseIodwasserstoffsäure kann prinzipiell auf folgenden Synthesewegen hergestellt werden: Ein Syntheseweg erfolgt mittels Verdrängungsreaktion. Hierbei wird das Iodid mittels einer starken Säure (Phosphorsäure) aus ihrem Salz vertrieben (Kaliumiodid). Es entsteht Iodwasserstoff und ein Phosphorsalz des Kaliums, Kaliumdihydrogenphosphat.
Eine weitere Synthese ist durch Oxidation von Schwefelwasserstoff mit Iod möglich. Dabei flockt elementarer Schwefel aus, währende der Iodwasserstoff gelöst bleibt. Der Schwefel kann anschließend abfiltriert werden.
Eine weitere Synthese von Iodwasserstoff erfolgt mittels eines Zweischritt-Prozesses: Zuerst wird Iod mit Phosphor in einer sauerstoffarmen Umgebung verbrannt. Anschließend wird das entstandene Phosphortriiodid langsam in Wasser gegeben.
NachweisDer Nachweis der Iodidionen kann mit Silbernitrat-Lösung vorgenommen werden. Hierbei wird ein gelber, äußerst schwerlöslicher Niederschlag von Silberiodid beobachtet. Dieser ist um Zehnerpotenzen schwerer löslich als jener der anderen Silberhalogenide. Deshalb wird bei Zugabe von gesättigter Silberchlorid-Lösung zu einer iodidhaltigen Lösung ein Niederschlag beobachtet. Kategorien: Ätzender Stoff | Chemische Lösung |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Iodwasserstoffsäure aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||