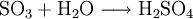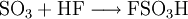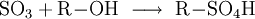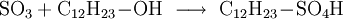Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Schwefeltrioxid
Schwefeltrioxid, SO3, bildet bei Normbedingungen farblose, nadelförmige Kristalle, die äußerst hygroskopisch sind und sehr heftig mit Wasser reagieren. Es existieren für den Feststoff Schwefeltrioxid drei verschiedene Modifikationen. Es ist das Anhydrid der Schwefelsäure. Schwefeltrioxid ist als sehr giftig beim Einatmen eingestuft und ist karzinogen. Das Einatmen des Rauches hat kaum Reizerscheinungen zur Folge, jedoch wandelt sich das Gas langsam in der Lunge in Schwefelsäure um und kann mit Verzögerung ein lebensgefährliches Lungenödem auslösen. Produkt-Highlight
GewinnungEs wird hergestellt durch eine katalytische Oxidation mit Vanadiumpentoxid von Schwefeldioxid und Luftsauerstoff bei 420 °C, siehe Kontaktverfahren. Herstellung kleiner Mengen SchwefeltrioxidIn den Kolben einer Normschliff-Destille werden 35 g trockenes Natriumpersulfat gegeben,dazu wird eine kleine Menge Konzentrierte Schwefelsäure gegeben,etwa 3-5 ml. Nun wird mit dem Brenner unter dem Abzug erhitzt. Es bilden sich rasch dichter weißer Nebel der aus Sauerstoff, Schwefeltrioxid und Ozon besteht. Bei weiterem Erhitzen bildet sich im Kolben eine farblose Schmelze, und die Nebelbildung lässt stark nach. Nun destilliert man mehrere Milliliter flüssiges Schwefeltrioxid ab, die in einer gekühlten Vorlage unter dem Abzug aufgefangen werden. Im Destillierkolben bleibt festes Natriumsulfat zurück. Als weitere Möglichkeit kann SO3 aus Schwefelsäure und Phosphorpentoxid abdestilliert werden. Es kann dabei auch H4P4O12 (Meta Phosphorsäure (cyclo-Phosphat)) als Ersatz zum Phosphorpentoxid verwendet werden. VerwendungEs dient hauptsächlich zur Herstellung von Schwefelsäure: Weiter zur Herstellung von Fluorsulfonsäure und Chlorsulfonsäure Vermischt man Schwefeltrioxid mit Alkoholen, entstehen Alkylschwefelsäuren: Diese Reaktion wird bei der Herstellung von Tensiden genutzt: Die Alkylschwefelsäure wird mit Natronlauge neutralisiert und fertig ist das Fettalkoholsulfat. Weiter ist Schwefeltrioxid als Oxidationsmittel geeignet. Es wurde auch zur Herstellung von Rauchgranaten benutzt, da bereits ein Tropfen flüssiges Schwefeltrioxid einen großen Raum komplett einnebeln kann. EigenschaftenDie angegebene Strukturformel setzt sich aus wie folgt aussehenden mesomeren Grenzstrukturen zusammen: Schwefeltrioxid verkohlt augenblicklich Gummi und die meisten Kunststoffe wie PVC, nur Teflon ist beständig. Quellen
Kategorien: Ätzender Stoff | Schwefelverbindung | Sauerstoffverbindung |
|||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Schwefeltrioxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||