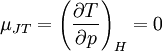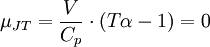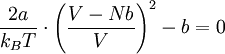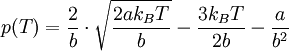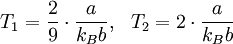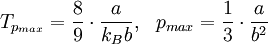Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Joule-Thomson-EffektDer Joule-Thomson-Effekt, nicht zu verwechseln mit dem Thomson-Effekt, tritt auf, wenn ein Gas oder Gasgemisch durch Drosselung (=Druckänderung) eine Temperaturänderung erfährt. Diese Erscheinung spielt eine wichtige Rolle in der Thermodynamik von Gasen und ist daher vor allem für die Technik von Bedeutung. Eine wichtige großtechnische Anwendung ist die Gasverflüssigung im Linde-Verfahren. Drosselt man ein Gas, etwa indem man in einer Rohrleitung eine Blende oder anderes Hindernis einbaut (siehe Grafik), expandiert es. Das heißt, das vom Gas eingenommene Volumen hinter dem Hindernis nimmt zu. Dabei nimmt auch der mittlere Teilchenabstand zu. Weiterhin verändert sich die Temperatur beim realen Gas. Bei realen Gasen wirken dabei anziehende oder abstoßende Kräfte zwischen den Teilchen, wobei in den meisten Fällen, wie etwa bei den Gasen der Luft bei Normaldruck, die anziehenden Kräfte vorherrschend sind. Wenn der mittlere Teilchenabstand zunimmt, wird Arbeit gegen die Anziehungskräfte, die zwischen den Teilchen wirken, verrichtet. Die Energie dazu kommt aus der kinetischen Energie des Gases, die dadurch verringert wird. Die Teilchen werden im Mittel langsamer und das Gas kühlt in der Folge ab. Ein ideales Gas zeigt keinen Joule-Thomson-Effekt, da zwischen seinen Teilchen keine Wechselwirkungen auftreten.
Produkt-Highlight
GeschichtlichesDer Joule-Thomson-Effekt wurde nach James Prescott Joule und Sir William Thomson (dem späteren Lord Kelvin) benannt, die dieses Phänomen im Jahre 1852 beschrieben. ThermodynamikJoule-Thomson-KoeffizientDie Stärke und Richtung der Temperaturänderung wird durch den Joule-Thomson-Koeffizient μ beschrieben: Er stellt die partielle Ableitung der Temperatur T nach dem Druck p bei konstanter Enthalpie H dar. Der Vorgang ist also isenthalp, was durch den Index H angedeutet wird. Im Allgemeinen kühlen sich Gase bei Ausdehnung ab, während sie sich bei Kompression erwärmen. Dazu gehören etwa Kohlendioxid und Luft. Für diesen Fall ist der Joule-Thomson-Koeffizient (bei Raumtemperatur) positiv. Einige Gase wie der Wasserstoff oder Helium verhalten sich umgekehrt. Sie erwärmen sich bei Ausdehnung und kühlen sich bei Kompression ab. Sie besitzen einen negativen Joule-Thomson-Koeffizienten. Für ideale Gase gilt: μJT = 0, siehe Joule-Versuch. Entscheidend für das Abkühlen eines Gases durch Expansion (Linde-Verfahren) ist daher, dass die Ausgangstemperatur unterhalb der Inversionstemperatur des jeweiligen Gases liegt. Diese liegt für Luft bei ca. +450 °C, für Wasserstoff bei −80 °C und für Helium bei −239 °C. Wird ein Gas unterhalb seiner Inversionstemperatur entspannt, so kühlt es sich ab, wird es oberhalb seiner Inversionstemperatur entspannt, so erwärmt es sich. Die Inversionstemperatur ist für ein Van-der-Waals-Gas Ti = 6,75 · Tk = 2a / Rb mit Tk=kritische Temperatur, a=Van-der-Waals-Konstante, b=Kovolumen. Herleitung des Joule-Thomson KoeffizientenThermodynamisch bleibt die Enthalpie H erhalten.
Totales Differential der Entropie S(T,p): Maxwellrelation der freien Enthalpie G: Thermischer Ausdehnungskoeffizient: Für ein ideales Gas ist Hierbei stehen die einzelnen Formelzeichen für folgende Größen:
Joule-Thomson-InversionskurveDie Kurve im Druck-Temperatur-Diagramm für die gilt wird als Joule-Thomson-Inversionskurve bezeichnet. Im von der Kurve eingeschlossenen Bereich gilt μJT > 0, außerhalb gilt μJT < 0.
Joule-Thomson-Inversionskurve für ein Van-der-Waals-Gas
Nach Einsetzen des Wärmeausdehnungskoeffizienten (α) erhält man folgende Gleichung: Durch Auflösen dieser Gleichung nach V und Einsetzen in die Van-der-Waals-Gleichung ergibt sich die Joule-Thomson-Inversions-Gleichung p(T): Für diese Gleichung ergeben sich folgende Nullstellen: und folgende Extrema: Technische Aspekte
Das Linde-Verfahren zur Gasverflüssigung setzt einen positiven Joule-Thomson-Koeffizienten voraus. Nur so kann die Energie des komprimierten Gases abgeführt werden, obwohl die Umgebungstemperatur höher ist als die des Gases. In der Linde-Maschine wird Luft durch ein Drosselventil von etwa 200 bar auf etwa 20 bar entspannt. Dabei kühlt sie sich um etwa 45 Kelvin ab. Die abgekühlte Luft wird nun genutzt, um weitere komprimierte Luft vor der Entspannung abzukühlen (Gegenstrom-Wärmeübertrager). Über mehrere Kompressions- und Entspannungsstufen kann somit das Gas soweit abgekühlt werden, dass es kondensiert und somit flüssig wird. Da der Joule-Thomson-Koeffizient von der Temperatur abhängt, kann es je nach verwendetem Gas sein, dass selbiges vorgekühlt werden muss, da es sich sonst noch weiter erwärmt, anstatt sich weiter abzukühlen. Beispielsweise muss Helium erst mit anderen Methoden auf ungefähr -228 °C (45 K) abgekühlt werden. Ein positiver Joule-Thomson-Koeffizient ist neben der Reibung mitverantwortlich dafür, dass Kompressionsanlagen gekühlt werden müssen, beziehungsweise dass komprimierte Gase bei einer höheren Umgebungstemperatur Wärme abgeben können. Dies wird bei der Brüdenkompression eingesetzt. Anwendungen
Literatur
|
|
| Dieser Artikel basiert auf dem Artikel Joule-Thomson-Effekt aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





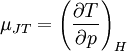
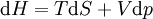 mit
mit 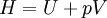
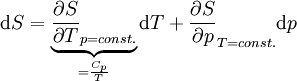
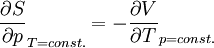
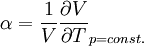
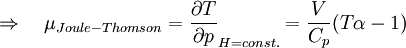
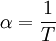 und somit ist der Joule-Thomson Effekt nicht beobachtbar.
Bei
und somit ist der Joule-Thomson Effekt nicht beobachtbar.
Bei