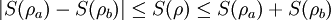Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Entropie
Die Entropie (griechisches Kunstwort εντροπία [entropía], von εν~ [en~] – ein~, in~ und τροπή [tropí] – Wendung, Umwandlung) ist eine extensive Zustandsgröße der Thermodynamik. Jedem Gleichgewichtszustand eines thermodynamischen Systems kann eindeutig ein Entropiewert zugeordnet werden. In der statistischen Physik stellt die Entropie ein Maß für das vom System erreichbare Phasenraumvolumen dar. Im Rahmen der klassischen Thermodynamik verkörpert die Entropie ein Maß für die adiabatische Erreichbarkeit. Produkt-Highlight
GrundlagenDie Entropie ist eine thermodynamische Größe, mit der Wärmeübertragungen und irreversible Vorgänge in thermodynamischen Prozessen rechnerisch erfasst und anschaulich dargestellt werden können (vergl. T-s-Diagramm). Die Entropie S (Einheit J/K) ist eine extensive Zustandsgröße wie das Volumen, die elektrische Ladung oder die Stoffmenge. Dividiert man durch die Masse, erhält man die spezifische Entropie s mit der Einheit J/(kg·K) als intensive Zustandsgröße. Der deutsche Physiker Rudolf Clausius führte den von ihm erfundenen Begriff 1865 zur Beschreibung von Kreisprozessen ein. Das Differential dS ist nach Clausius bei reversiblen Vorgängen das Verhältnis von übertragener Wärme δQ und absoluter Temperatur T: Diese Entropieänderung ist bei Wärmezufuhr positiv, bei Wärmeabfuhr negativ. Clausius beschrieb auch die Entropievermehrung ohne Wärmeübertragung durch irreversible Vorgänge in einem isolierten System mit der Ungleichung: Man unterscheidet heute zwischen der transportierten Entropie (1. Gleichung) und der produzierten Entropie (2. Gleichung) und fasst − allgemein gültig, also auch für das nicht adiabate System - beide Gleichungen zusammen: Dabei ist δWdiss die innerhalb des Systems dissipierte Arbeit, die immer positiv ist, also dem System zugeführt wird (z. B. Reibungsarbeit). Die 3. Gleichung ist eine Form des zweiten Hauptsatzes der Thermodynamik. Das Differential dS existiert allerdings nur für quasi-statische Zustandsänderungen, d. h., dass eine Folge von Zuständen messtechnisch erfasst werden kann (Zustände mit nur geringen Ungleichgewichten). Bei dem im Bild dargestellten Vorgang im adiabaten System, bei dem nur Anfangszustand und Endzustand angegeben werden können, wäre das nicht der Fall. Für ein ideales Gas kann aber die Entropiedifferenz auf einfache Weise über einen reversiblen isothermen Ersatzprozess (Abgabe von Arbeit und Aufnahme von Wärme aus der Umgebung) berechnet werden, wie dies im Abschnitt Beispiele geschehen ist. Geschichte des Begriffes „Entropie“Die Entropie ist neben der Energie der wichtigste Begriff der Thermodynamik und es ist hilfreich, sich für ein besseres Verständnis an den Ausgangspunkt dieser Wissenschaft zu begeben und die Entwicklung zu rekapitulieren. Im Jahre 1712 wurde die erste Dampfmaschine von Thomas Newcomen in einem Bergwerk installiert, um Wasser zu pumpen. Die Maschine wurde ihrer Aufgabe gerecht, benötigte aber sehr viel Brennstoff. Zu diesem Zeitpunkt war der Zusammenhang zwischen Energie und Wärme völlig unklar und es sollten noch über 130 Jahre vergehen, bis Julius Mayer den 1. Hauptsatz der Thermodynamik publizierte. Ab 1764 verbesserte James Watt die Dampfmaschine und konnte deren Wirkungsgrad auf über 1% mehr als verdoppeln, ohne die zugrundeliegende Theorie zu kennen. Erst 60 Jahre später hatte der junge französische Ingenieur Sadi Carnot die entscheidende Idee, die er 1824 publizierte. Inspiriert von der Arbeit seines Vaters über Wassermühlen beschrieb Carnot eine Dampfmaschine durch einen zyklischen Prozess, bei dem Wärme von einer heißen Quelle zu einer kalten Senke fließt und dabei Arbeit leistet. Das Verhältnis von entnommener mechanischer Arbeit ΔW zu eingeleiteter Wärme ΔQ war der Wirkungsgrad: In seiner ursprünglichen Schrift vertrat Carnot die Meinung, dass Wärme eine Art unwägbarer Stoff sei, der immer von einem heißen zu einem kühleren Körper fließt, ähnlich wie Wasser sich immer bergab bewegt. Und genau wie herabstürzendes Wasser konnte Wärme umso mehr Arbeit leisten je höher das Gefälle war, insbesondere konnte die Maschine nicht mehr Arbeit leisten als Wärme zugeführt wurde. Carnot korrigierte sich später und erkannte bereits ein Jahrzehnt vor Mayer, Joule und Thomson die Äquivalenz von Wärme und Energie. Er war also seiner Zeit weit voraus, leider starb er jung und sein Werk blieb zunächst unbemerkt. Erst Clausius formulierte den Zusammenhang von Temperaturdifferenz - der Quelle und Senke - mit dem Wirkungsgrad der Carnot-Maschine und dass dieser Wirkungsgrad nicht von einer anderen Wärmekraftmaschine überschritten werden kann, da sonst Wärme spontan von einem kalten zu einem heißen Körper fließen würde. Die Unmöglichkeit eines solchen Vorgangs in der Natur bezeichnet man heute als 2. Hauptsatz der Thermodynamik. Clausius formulierte ihn mit einem Kreisprozess: Es existiert keine zyklisch arbeitende Maschine, deren einzige Wirkung Wärmetransport von einem kühleren zu einem wärmeren Reservoir ist. Einfacher ausgedrückt besagt also der 2. Hauptsatz, dass Temperaturdifferenzen sich in der Natur nicht spontan vergrößern können. Clausius konnte mit dieser Forderung den Satz für beliebige Kreisprozesse herleiten. Das Gleichheitszeichen gilt dabei nur für reversible Prozesse. Mit diesem Satz von Clausius liegt es auf der Hand die Größe differentiell zu definieren. Clausius nannte diese Größe Entropie und es wurde mit der Zeit üblich, den 2. Hauptsatz direkt mit der Entropie zu formulieren, was keineswegs zu einem tieferen Verständnis führt. Erst Jahrzehnte später konnte Ludwig Boltzmann mit seiner statistischen Mechanik eine Erklärung für die Entropie als Maß für die erreichbaren Mikrozustände des Systems finden. Wärme ist zufällig über Atome und Moleküle verteilte Energie und fließt von heiß nach kalt, weil der umgekehrte Weg einfach zu unwahrscheinlich ist. Im Jahre 1999 haben die theoretischen Physiker Elliott Lieb und Jakob Yngvason die Definition der Entropie in der phänomenologischen Thermodynamik auf eine streng axiomatische Basis gestellt. Diese Definition macht keinen Gebrauch von Größen wie „Wärme“ und „Temperatur“, die sich ohne Entropie nicht exakt definieren lassen, sondern beruht auf dem Konzept der adiabatischen Erreichbarkeit. Hilfestellung zum VerständnisEnergie wird – entgegen der landläufigen Redeweise – im physikalischen Sinn nicht verbraucht, sondern nur umgewandelt, z. B. in Maschinen (1. Hauptsatz der Thermodynamik – Energieerhaltung). Einem Benzinmotor wird also im Laufe eines Zyklus dieselbe Energiemenge in Form von Kraftstoff zugeführt, wie als Antriebsarbeit und Wärme abgeführt wird. Da auch die Antriebsarbeit durch Reibung schließlich in Wärme umgesetzt wird, landet am Ende der gesamte Energieinhalt des Kraftstoffes als Wärmemenge in der Umgebung, sieht man von eventuell in potentielle Energie oder mechanisch in Deformationsenergie umgewandelten Anteilen ab. Die Energie wurde also nicht verbraucht, sondern lediglich umgewandelt. Man benötigte also eine Größe, um die Arbeitsfähigkeit der Energie zu beschreiben, da die Energiemenge alleine nichts über die Arbeitsfähigkeit aussagt. So enthalten die Weltmeere theoretisch eine riesige Energiemenge. Da diese aber bei Umgebungstemperatur vorliegt, kann damit keine Arbeit geleistet werden. Clausius fand nun heraus, dass man mit einer Energiemenge um so mehr Arbeit leisten kann, je höher die Temperatur ist, bei der sie der Maschine zugeführt wird (siehe Carnot-Wirkungsgrad). Am Beispiel des Motors wird die Kraftstoffenergie durch die Verbrennung dem Motor bei ca. 2000–2500 °C zugeführt und verlässt ihn wieder bei ca. 50 °C durch den Kühler sowie über die Räder. Mit Hilfe der Gleichungen von Clausius kann man nun genau vorhersagen, wie viel Arbeitsleistung der Motor maximal erbringen könnte. Die zugeführte Energie hat dabei eine geringe Entropie, während die Abwärme eine hohe Entropie hat. Aus der Differenz lässt sich die mögliche Arbeitsleistung berechnen. Problematik des Begriffs EntropieIn populärwissenschaftlichen Büchern, aber auch in vielen Lehrbüchern wird die Entropie mit Unordnung gleichgesetzt. Diese Analogie trifft für einige Systeme zu, z. B. besitzt ein geordneter Kristall eine viel geringere Entropie als seine Schmelze. Für andere Systeme ist diese Betrachtung eher problematisch, z. B. besitzt eine geordnete Biomembran in Wasser eine höhere Entropie als ihre ungeordneten, in Wasser gelösten Bestandteile (siehe Beispiele unten). Das Problem besteht in erster Linie darin, dass der umgangssprachliche Begriff Unordnung nicht eindeutig definiert ist und die Entropie kein Maß für die Symmetrie des Systems darstellt, sondern für die Anzahl der mikroskopisch erreichbaren Zustände, unabhängig von ihrem wie auch immer definierten Ordnungsgrad. Insbesondere in Lehrbüchern der theoretischen Physik wird der Begriff Unordnung deshalb gemieden. Verwirrung entsteht auch dadurch, dass der Begriff der Entropie in unterschiedlichen Disziplinen mit Bezug auf unterschiedliche Phänomene verwendet wird. Die Entdeckung der Entropie im Zusammenhang mit der Thermodynamik und ihre zentrale Rolle für diese Theorie beschränkte nicht ihre Übertragung auf andere Bereiche, wie z. B. der Informationstheorie. Die Entropie ist eine statistisch definierte Größe und kann in vielen Kontexten sinnvoll verwendet werden. Unbeschadet dessen können die Definitionen in den Einzeldisziplinen inkonsistent oder sogar widersprüchlich sein. So nutzte Norbert Wiener den Begriff der Entropie ebenso zur Beschreibung von Informationsphänomenen wie Claude Elwood Shannon, allerdings mit einem negativen Vorzeichen. Dass sich die Definition von Shannon durchgesetzt hat, ist vor allem der besseren technischen Verwertbarkeit seiner Arbeiten zuzuschreiben. Es wird aber aus diesem Beispiel deutlich, dass bei einer interdisziplinären Anwendung des Entropiebegriffes mindestens Vorsicht und eine genaue Quellenanalyse geboten ist. Die Entropie ist keine direkt messbare statistische Größe, wie z. B. die Temperatur und der Druck. Es können nur Änderungen der Entropie erfasst werden, und sie ist auch keine strenge Erhaltungsgröße wie Energie, Masse, Teilchenzahl oder Ladung eines Systems. Dies ist auch ein wesentlicher Unterschied zwischen erstem und zweitem Hauptsatz der Thermodynamik. Während der erste Hauptsatz nichts anderes als die Formulierung des streng gültigen Energieerhaltungssatzes in der Sprache der Thermodynamik ist, stellt der zweite Hauptsatz nur eine statistisch gerechtfertigte Behauptung dar. Allerdings ist die Wahrscheinlichkeit für einen Verstoß gegen den zweiten Hauptsatz in makroskopischen Systemen extrem gering. Er kann allerdings nicht direkt aus den mikroskopischen Gleichungen gefolgert werden und wurde sogar im Rahmen der klassischen Mechanik durch Poincaré widerlegt. All diese Eigenschaften führen zu Problemen beim Verständnis des Begriffs der Entropie. Entropie in der ThermodynamikEin idealer, jederzeit umkehrbarer Prozess ohne Reibungsverluste wird auch reversibel genannt. Oft bleibt die Entropie während eines Prozesses unverändert, ΔS = 0, bekanntes Beispiel ist die adiabate Kompression und Expansion im Zyklus einer Carnot-Maschine. Man nennt Zustandsänderungen mit konstanter Entropie auch isentrop, allerdings sind nicht alle isentropen Zustandsänderungen adiabat. Ist ein Prozess adiabat und reversibel folgt jedoch stets, dass er auch isentrop ist. Wird in einem Kreisprozess bei der Temperatur Th die Wärme Qh aufgenommen und die Wärmemenge Ql bei Tl wieder abgegeben, gilt, dass sich die Entropie ändert: Daraus lassen sich die maximale Energieleistung A = Qh − Ql und der maximale Wirkungsgrad ableiten. Ähnlich wie die Temperatur die statistisch gemittelte Energie der Teilchen eines Vielteilchensystems angibt, konnte Boltzmann zeigen, dass sich auch die Entropie statistisch erfassen lässt, und zwar als Funktion der Zahl der besetzbaren Zustände in einem Vielteilchensystem: kB ist die Boltzmann-Konstante, ln der natürliche Logarithmus und Ω die Zahl der Zustände, die die Teilchen eines Systems einnehmen können. Die Wahl der Basis des Logarithmus ist unkritisch, sie bewirkt lediglich eine Änderung des konstanten Faktors.
Das Bild rechts zeigt die Mischung einer braunen Farbe in Wasser. Zu Beginn ist die Farbe ungleichmäßig verteilt. Nach längerem Warten nimmt das Wasser eine gleichmäßige Färbung an. Die Entropie ist ein Maß für Unwissenheit. Als Maß für Unordnung muss man genau auf die Begrifflichkeit achten. So ist im Bildbeispiel die Flüssigkeit im rechten Glas zwar „ordentlicher“ verrührt, aber durch die große Durchmischung von Wasser- und Farbteilchen herrscht dort eine größere Unordnung. Mithin ist dort die Entropie höher als im linken Glas. Von der Farbe wissen wir, dass sie im rechten Glas überall im Wasser verteilt ist. Das linke Bild sagt uns mehr. Wir können Bereiche ausmachen, in denen Farbe in hoher Konzentration anzutreffen ist oder Bereiche, die frei sind von Farbe. Die Mischungsentropie lässt sich berechnen. Josiah Willard Gibbs wies auf den Widerspruch hin, dass der Entropiezuwachs auch auftreten sollte, wenn statt der Tinte Wasser ins Wasserglas gegossen wird (Gibbssches Paradoxon). Die Zahl der Anordnungen der Farbmoleküle am Anfang ist deutlich geringer als die, wenn sich die Farbe im gesamten Volumen verteilen kann. Denn die Farbmoleküle sind nur auf wenige Bereiche konzentriert. Im rechten Bild können sie sich im gesamten Glas aufhalten. Die Entropie ist hier größer, weshalb das System im Lauf der Zeit dieser Gleichverteilung zustrebt. Die Entropie bleibt nur dann unverändert, wenn die Prozesse reversibel verlaufen. Reale Zustandsänderungen sind immer mit Energieverlusten (z. B. durch Reibung) verbunden, wodurch sich die Entropie erhöht. Eine Verringerung der Gesamtentropie in einem geschlossenen System ist nicht möglich. Aber die Entropie kann lokal verkleinert werden, wenn sie an anderen Orten des Systems entsprechend anwächst. Zweiter und dritter HauptsatzRudolf Julius Emanuel Clausius hatte erkannt, dass die durch differentiell gegebene Größe eine extensive Zustandsgröße darstellt, also unabhängig vom Reaktionspfad und proportional zur Systemgröße ist. Die Bezeichnung δQreversibel statt dQ betont, dass die Änderung der Wärme wegabhängig ist (Beispiel siehe Kreisprozess) und deshalb kein vollständiges Differential ist. Clausius fand außerdem, dass in einem isolierten System die Entropie monoton wächst: Er formulierte diese Beobachtung im 2. Hauptsatz der Thermodynamik als Negation der Existenz eines Perpetuum mobile zweiter Art: „Es existiert kein Kreisprozess, dessen einzige Wirkung darin besteht, Wärme von einem kälteren Reservoir zu einem wärmeren Reservoir zu transportieren.“ Offenbar hätte man sonst eine unerschöpfliche Energiequelle konstruiert. Äquivalent dazu ist die Formulierung von William Thomson: „Es existiert kein Kreisprozess, der eine Wärmemenge aus einem Reservoir entnimmt und vollständig in Arbeit verwandelt.“ Im Gegensatz zu den bereits bekannten extensiven Größen von thermodynamischen Systemen, wie Energie E, Volumen V und Masse m, entzog sich die Entropie zunächst dem tieferen Verständnis. Die Entropie konnte erst im Rahmen der statistischen Mechanik von Ludwig Boltzmann befriedigend als Maß für das Phasenraumvolumen erklärt werden, das von der Phasentrajektorie des Systems unter Einhaltung der Konstanz ausgewählter makroskopischer Observablen, wie Temperatur T, Volumen V oder Teilchenzahl N, erreicht werden kann. Anschaulich ist die Entropie demnach ein Maß für fehlende Information über den tatsächlichen Mikrozustand, wenn lediglich eine geringe Anzahl beobachtbarer Größen zur Charakterisierung des Makrozustands vorliegen. Die Ergodenhypothese behauptet, dass die Trajektorie des Systems tatsächlich im Laufe der Zeit das gesamte durch die Entropie gemessene Phasenvolumen überdeckt. Systeme, die dieses Verhalten zeigen, nennt man auch ergodisch. Nur bei diesen kann der 2. Hauptsatz sinnvoll angewandt werden. Eng damit verbunden ist die Irreversibilität von Prozessen in der Natur. Der dritte Hauptsatz (der so genannte „Nernstsche Wärmesatz“) legt die Entropie einer perfekt kristallinen Substanz am absoluten Nullpunkt als Null fest:
Eine Folgerung ist beispielsweise, dass die Wärmekapazität eines Systems bei tiefen Temperaturen verschwindet. Beispiele
Expansionsversuch von Gay-Lussac: In der Einleitung wird das Experiment von Gay-Lussac beschrieben. Wie groß ist nun die Entropieänderung in dem beschrieben Versuch? Da die Entropie eine Zustandsgröße ist, ist sie wegunabhängig. Anstatt die Trennwand herauszuziehen, kann man sie auch langsam nach rechts schieben, bis das Endvolumen erreicht ist. Für eine infinitesimale Verschiebung vergrößert sich das Volumen um dV, die Entropie steigt um dS = ΔQ / T. Aus dem ersten Hauptsatz dU = ΔQ + ΔW folgt mit dU = 0 und ΔW = − pdV, da ausschließlich Volumenarbeit verrichtet wird: Aus dem idealen Gasgesetz (N ist die Anzahl der Gasatome) folgt:
Hieraus ergibt sich durch Integration sofort:
Da in obigen Beispiel N = 47 Atome eingezeichnet sind gilt:
Realistischer wäre z. B. 1 mol Atome, also ergibt. Zahlenbeispiel: In einem System, welches mit seiner Umgebung weder Masse noch Energie austauscht, kann die Entropie niemals spontan abnehmen. Beispiel: Ein Kilogramm Wasser besitzt bei 10 °C die Entropie Biomembranen: Gibt man Lipide, also die Bausteine der Biomembranen, in Wasser, so bilden sich spontan geschlossene Membranstrukturen, sogenannte Vesikel. Da hier Temperatur und Druck gegeben sind (Wärmebad und Druckensemble) ist das thermodynamische Potential, das ein Minimum anstrebt die freie Enthalpie ΔG = ΔH − TΔS. Die Enthalpie ΔH lässt sich experimentell messen und ist positiv. Da der Prozess spontan abläuft muss aber ΔG negativ sein, d. h. die Entropie muss steigen. Dies ist auf den ersten Blick verwirrend, da die Entropie meistens dafür verantwortlich ist, dass sich Substanzen vermischen (Mischungsentropie). Die Entropiezunahme liegt in einer besonderen Eigenschaft des Wassers begründet. Es bildet zwischen den einzelnen Wassermolekülen Wasserstoffbrückenbindungen aus, die ständig fluktuieren und somit einen hohen Beitrag zur Entropie des Wassers leisten. Um die langen Fettsäureketten der Lipide entsteht bei Lösung in Wasser ein größerer Bereich, in dem keine Wasserstoffbrückenbindungen mehr gebildet werden können. In den Bereichen um die Fettsäureketten herum fehlt der Entropiebeitrag der Wasserstoffbrücken, so dass die Entropie insgesamt abnimmt. Diese Abnahme ist erheblich größer als die durch das bloße Vermischen des Wassers und des Lipids zu erwartende Zunahme. Wenn sich die Fettsäureketten zusammenlagern, können mehr Wasserstoffbrücken gebildet werden, und die Entropie steigt. Man könnte dies auch so formulieren, dass die Fähigkeit des Wassers, fluktuierende Wasserstoffbrücken zu bilden, die Lipide aus der Lösung treibt. Letztlich ist diese Eigenschaft auch mit für die schlechte Löslichkeit vieler unpolarer Substanzen verantwortlich, die die Bildung von Wasserstoffbrückenbindungen stören. Lebende Organismen: Ein lebender Organismus kann in gewissem Sinne als eine thermodynamische Maschine betrachtet werden, die chemische Energie in Arbeit und Wärme umwandelt und gleichzeitig Entropie produziert. Es ist jedoch nach dem gegenwärtigen Stand der Forschung noch nicht geklärt, ob sich einem biologischen System eine Entropie zuordnen lässt, da es sich nicht im Zustand des thermodynamischen Gleichgewichts befindet. Andere Disziplinen: Neben ihrer Rolle als fundamentale Zustandsgröße der phänomenologischen und statistischen Thermodynamik wird die Entropie in anderen Gebieten, insbesondere in der Informationstheorie und in der Wirtschaftswissenschaft benutzt. Die Entropie besitzt in diesen Gebieten eine eigenständige Bedeutung. So ist es z. B. in der Astrophysik notwendig, bei der Beschreibung von Sterngeburten, weißen Zwergen, Neutronensternen, schwarzen Löchern (sie haben die höchste Entropie aller bekannten physikalischen Systeme), Kugelsternhaufen, Galaxien(haufen) und letztendlich dem ganzen Kosmos auf den Begriff der Entropie zurückzugreifen. Statistische PhysikUm 1880 konnte Ludwig Boltzmann mit der von ihm und James Maxwell begründeten statistischen Physik auf mikroskopischer Ebene die Entropie erklären. In der statistischen Mechanik wird das Verhalten makroskopischer thermodynamischer Systeme durch das mikroskopische Verhalten seiner Komponenten, also Elementarteilchen und daraus zusammengesetzter Systeme wie Atome und Moleküle, erklärt. Ein Mikrozustand ist klassisch gegeben durch Angabe aller Orte und Impulse der zum System zählenden Teilchen. Ein solcher Mikrozustand in der Einheit J/K. Um diese Rechnung konkret ausführen zu können, müssen also zunächst die makroskopischen Observablen des betrachteten Systems bekannt sein. Die Konstante kB wird in Anerkennung der Leistungen Ludwig Boltzmanns bei der Entwicklung der statistischen Theorie als Boltzmann-Konstante bezeichnet, er selbst hat ihren Wert jedoch nicht bestimmt. QuantenmechanikIn der Quantenstatistik ist ein Mikrozustand gegeben durch einen Vektor Dieser reine Zustand enthält alle Informationen über das System, die durch eine ideale Messung zugänglich sind. Ein Makrozustand ist klassisch gegeben durch ein Ensemble von Mikrozuständen, die bestimmte Erhaltungsgrößen gemein haben, wie z. B. Energie, Volumen und Teilchenzahl. Die Verteilung der Mikrozustände im Phasenraum ist gegeben durch eine Verteilungsfunktion Der Erwartungswert einer Observablen auf dem durch den Dichteoperator beschriebenen gemischten Zustand ist gegeben durch Die Entropie ist über die Wahrscheinlichkeiten der einzelnen Mikrozustände im Makrozustand gegeben durch wobei pi die Wahrscheinlichkeit ist, im i-ten Mikrozustand zu sein (siehe Stirling-Formel zur Herleitung dieser Relation). kB ist die Boltzmann-Konstante. Als Beispiel nehmen wir ein Spinsystem mit 4 Elektronen. Die Gesamtenergie soll − 2μB sein. Daraus folgt, dass Ω = 4 Die allgemeine Formel ist bis auf einen konstanten Faktor identisch mit der Formel für die Informationsentropie. Das bedeutet, die physikalische Entropie ist auch ein Maß für die Information, die einem durch Kenntnis des Makrozustands zum Mikrozustand fehlt. Der 2. Hauptsatz der Thermodynamik wird in der statistischen Mechanik eine Wahrscheinlichkeitsaussage: Es ist rein theoretisch möglich, dass beispielsweise Wärme vom kälteren Körper zum wärmeren fließt, aber es ist so unwahrscheinlich, dass es selbst in einer Zeit, die dem Millionenfachen des Alters des Universums entspricht, mit an Sicherheit grenzender Wahrscheinlichkeit nicht passieren wird. Bei realen Systemen und normalen Temperaturen lassen sich keine einzelnen Zustände mehr abzählen. An Stelle der Anzahl der Zustände tritt dann das erreichbare Volumen im vieldimensionalen Phasenraum. Eigenschaften der statistischen Entropie eines quantenmechanischen ZustandesSeien
Zitate
LiteraturLehrbücher
Populärwissenschaftliche Darstellungen
|
|||
| Dieser Artikel basiert auf dem Artikel Entropie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





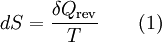
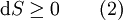
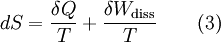
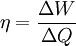
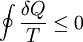
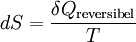
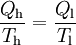
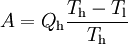
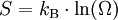
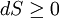
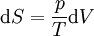
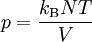
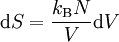 .
.
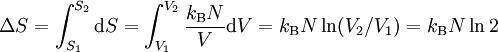 .
.
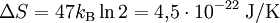 .
.
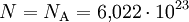 Atome, womit sich
Atome, womit sich
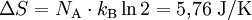
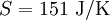 , bei 20 °C
, bei 20 °C 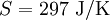 , bei 30 °C
, bei 30 °C 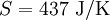 . 1 kg kaltes Wasser (10 °C) und 1 kg warmes Wasser (30 °C) können bei Berührung spontan in den Zustand 2 kg lauwarmes Wasser (20 °C) übergehen, weil die Entropie des Anfangszustandes (151 + 437 = 588) kleiner ist als die Entropie des Endzustandes (297 + 297 = 594). Die spontane Umkehrung dieses Vorganges ist nicht möglich, weil sich hierbei die Entropie des aus 2 kg Wasser bestehenden Systems von 594 J/K auf 588 J/K verringern müsste, was dem zweiten Hauptsatz der Thermodynamik widerspräche.
. 1 kg kaltes Wasser (10 °C) und 1 kg warmes Wasser (30 °C) können bei Berührung spontan in den Zustand 2 kg lauwarmes Wasser (20 °C) übergehen, weil die Entropie des Anfangszustandes (151 + 437 = 588) kleiner ist als die Entropie des Endzustandes (297 + 297 = 594). Die spontane Umkehrung dieses Vorganges ist nicht möglich, weil sich hierbei die Entropie des aus 2 kg Wasser bestehenden Systems von 594 J/K auf 588 J/K verringern müsste, was dem zweiten Hauptsatz der Thermodynamik widerspräche.
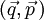 ist demnach ein Element eines 6N-dimensionalen Vektorraums, der in diesem Zusammenhang Phasenraum genannt wird. Die kanonischen Gleichungen der klassischen Mechanik beschreiben die zeitliche Evolution des Systems, die Phasentrajektorie. Alle unter gegebenen makroskopischen Randbedingungen, wie z. B. Gesamtenergie E, Volumen V und Teilchenzahl N, erreichbaren Phasenpunkte bilden ein zusammenhängendes Phasenraumvolumen
ist demnach ein Element eines 6N-dimensionalen Vektorraums, der in diesem Zusammenhang Phasenraum genannt wird. Die kanonischen Gleichungen der klassischen Mechanik beschreiben die zeitliche Evolution des Systems, die Phasentrajektorie. Alle unter gegebenen makroskopischen Randbedingungen, wie z. B. Gesamtenergie E, Volumen V und Teilchenzahl N, erreichbaren Phasenpunkte bilden ein zusammenhängendes Phasenraumvolumen 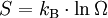
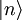 im
im 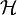 .
.
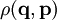 , an deren Stelle in der quantenmechanischen Beschreibung der
, an deren Stelle in der quantenmechanischen Beschreibung der 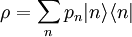
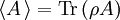
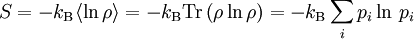
![[\uparrow \downarrow \downarrow \downarrow] \quad [\downarrow \uparrow \downarrow \downarrow] \quad [\downarrow \downarrow \uparrow \downarrow] \quad [\downarrow \downarrow \downarrow \uparrow]](images/math/7/c/8/7c82ee5f9979707ef8ff0d77d0bae447.png)
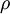 und
und 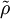 Dichteoperatoren auf dem Hilbertraum
Dichteoperatoren auf dem Hilbertraum 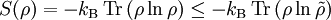
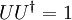 )
)
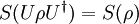
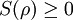
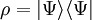 angenommen
angenommen
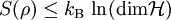
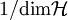 auftreten
auftreten
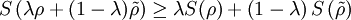 mit
mit 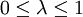
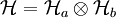 und
und 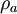 bzw.
bzw. 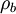 reduzierte Dichteoperatoren auf
reduzierte Dichteoperatoren auf 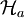 bzw.
bzw.