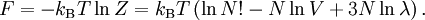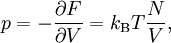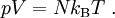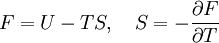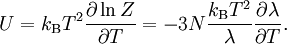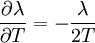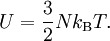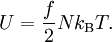Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Ideales GasAls ideales Gas bezeichnet man in der Physik und Physikalischen Chemie die idealisierte Modellvorstellung eines Gases. Obwohl es eine starke Vereinfachung darstellt, lassen sich mit diesem Modell bereits viele thermodynamische Prozesse von Gasen verstehen und mathematisch beschreiben. Produkt-Highlight
Modell des idealen GasesIm Modell des idealen Gases werden alle Gasteilchen als ausdehnungslose Massepunkte angenommen, welche sich frei durch das ihnen zur Verfügung stehende Volumen bewegen können. Mit frei ist gemeint, dass die Teilchen keinerlei Kräfte verspüren. Allerdings dürfen (und müssen) sich die Teilchen untereinander und an der Wand des Volumens stoßen. Ein Gasteilchen bewegt sich also geradlinig mit einer konstanten Geschwindigkeit, bis ein Stoß (ein elastischer) es in eine andere Richtung lenken und dabei beschleunigen oder abbremsen kann. Die Annahme von Stößen bei ausdehnungslosen Teilchen ist im Grunde paradox, stellt jedoch eine formale Notwendigkeit dar. Ließe man keine Stöße zu, so könnte man das Gas zum einen nicht in ein Volumen einsperren, da es die Wand nicht bemerkte, und zum anderen behielte jedes Gasteilchen für alle Zeiten seine Anfangsgeschwindigkeit. Letzteres würde verhindern, dass sich die Energie des Gases im Mittel gleichmäßig auf alle Teilchen verteilen könnte. Ein solches System kann sich aber nicht im thermodynamischen Gleichgewicht befinden, welches eine zwingende Voraussetzung für Anwendbarkeit der thermodynamischen Hauptsätze ist. Durch die Stöße bewegen sich die Teilchen nur eine kurze Weglänge frei. Damit es zu Stößen kommt, muß ein Stoßquerschnitt angenommen werden. Allerdings ist der Stoßquerschnitt temperaturabhängig (Sutherlandkonstante) Siehe auch: Kinetische Gastheorie Thermodynamik
ZustandsgleichungenDie thermische Zustandsgleichung zur Beschreibung eines idealen Gases heißt allgemeine Gasgleichung. Sie wurde zuerst aus verschiedenen einzelnen empirischen Gasgesetzen hergeleitet. Später erlaubte die Boltzmann-Statistik eine direkte Begründung ausgehend von der mikroskopischen Beschreibung des Systems aus einzelnen Gaspartikel. Die allgemeine Gasgleichung beschreibt die Abhängigkeiten der Zustandsgrößen des idealen Gases voneinander. In der Literatur wird sie üblicherweise in einer der folgenden Formen angegeben: wobei Neben der thermischen gibt es in der Thermodynamik noch die kalorische Zustandsgleichung. Diese lautet für das ideale Gas (ohne innere Freiheitsgrade): Allerdings sind thermische und kalorische Zustandsgleichung voneinander abhängig, was der zweite Hauptsatz der Thermodynamik nennt. Eigenschaften von idealen GasenEin ideales Gas hat eine Reihe von besonderen Eigenschaften, die alle aus der allgemeinen Gasgleichung und den Hauptsätzen der Thermodynamik gefolgert werden können. Die allgemeine Gasgleichung ist die kompakte Zusammenfassung einer Reihe von Gesetzen: Satz von Avogadro
Die Stoffmenge n als Maß für die Anzahl der Teilchen (Atome oder Moleküle) wird in der internationalen Einheit Mol gemessen.
Das Mol ist also ein Vielfaches der Einheit, vergleichbar mit dem Dutzend. Das Volumen eines idealen Gases mit einer Stoffmenge n = 1mol bei Normalbedingungen ( Die molare Masse M (Masse von 1 mol) entspricht also der Masse einer Gasmenge, die bei 0 °C und
Dieses Gesetz ist die Grundlage für das Gasthermometer von Jolly.
Molares Volumen eines idealen GasesDas molare Volumen eines idealen Gases Vm0 ist eine fundamentale physikalische Konstante, die das molare Volumen eines idealen Gases unter Normalbedingungen, d. h. bei Normaldruck p0 = 101 325 Pa und Normaltemperatur T0 = 273,15 K angibt. Sein derzeit allgemein empfohlener Wert beträgt nach CODATA 2006 [1]
Es errechnet sich über die universelle Gaskonstante R nach
Thermodynamische GrößenAllgemein gilt für ein ideales Gas:
Bei Normalbedingungen gilt für ein ideales Gas:
Ideales Gasgemisch
Nebenstehend die Zeitrafferdarstellung der reversiblen Entmischung eines idealen Gasgemischs mittels semipermeablen Membranen. Die linke (rote) Membran ist durchlässig für Komponente A (grün) und undurchlässig für Komponente B (braun), während umgekehrt die rechte (blaue) Membran für Komponente A undurchlässig und für Komponente B durchlässig ist. Die Kolben haben gleiche Abmessungen und bewegen sich gleich schnell. Die gesamte von den äußeren Kräften (rote Pfeile auf den Zylindern) geleistete Arbeit beträgt Null. Erfahrungsgemäss tritt bei der Mischung von idealen Gasen keine Mischungswärme auf und das selbe gilt für die reversible Entmischung. Es wird weder Arbeit noch Wärme mit der Umgebung ausgetauscht. Da der Vorgang reversibel ist, bleibt die Entropie konstant. Bezeichnet V die Volumenänderung pro Hub, p den Druck, S die Entropie und T die Temperatur des Gemischs, und VA, pA, SA, TA und VB, pB, SB, TB die entsprechenden Größen der Komponente A bzw B, so gilt:
Analog gilt für ein mehrkomponentiges ideales Gasgemisch:
wenn S(T,V) die Entropie des Gemischs und Si(T,V) die Entropie der separaten i − ten Komponente bei der Temperatur T und dem Volumen V bezeichnet. Ideale Gase gleicher Temperatur überlagern sich in einem gemeinsamen Volumen ohne gegenseitige Beeinflussung, wobei sich der Druck (Daltonsches Gesetz), die thermodynamischen Potentiale (Entropie, innere Energie, Enthalpie etc.) sowie die Wärmekapazitäten der einzelnen Bestandteile zu den entsprechenden Grössen des Gemischs addieren. Mischungsentropie eines idealen Gasgemischs
Nebenstehende Abbildung zeigt, wie durch Diffusion aus zwei ursprünglich getrennten Gasen ein einheitliches Gemisch entsteht. Die Temperaturen T1 = T2 und Drücke p1 = p2 der anfangs getrennten Gase (grün bzw braun) seien gleich. Durch Drehung des oberen der beiden zylindrischen Behälter, die mit ihren ebenen Dichtflächen aneinander liegen (1), werden die abgeschlossenen Volumina V1 und V2 zum abgeschlossenen Volumen V = V1 + V2 vereinigt. Die darin enthaltenen Gase diffundieren ineinander (2), bis schließlich, von selbst ohne äußere Einwirkung, ein einheitliches (homogenes) Gemisch entstanden ist, bei dem jeder Bestandteil gleichmäßig über das gesamte Volumen V verteilt ist (3). Verhalten sich die Gase wie ideale Gase, so tritt bei diesem Diffusionsvorgang keine Mischungswärme auf und es gilt:
wobei n1 und n2 die Molzahlen der getrennten Gase bezeichnen. Die Mischungsentropie entspricht der Entropieänderung bei Expansion der Gase von ihren ursprünglichen Volumina V1 bzw V2 auf das gemeinsame Gemischvolumen V: oder mit n1, n2 und n = n1 + n2: Für ein mehrkomponentiges ideales Gasgemisch gilt analog: Diese Formel gilt, wenn die getrennten Gase keine identischen Bestandteile enthalten, und zwar auch für chemisch sehr ähnliche Gase wie z. B. Ortho- und Parawasserstoff. Sie gilt näherungsweise auch für die Mischungsentropie von realen Gasen, und zwar umso genauer, je besser diese die ideale Gasgleichung erfüllen. Wenn die beiden Teilvolumina V1 und V2 jedoch identische Gase enthalten, so findet beim Zusammenbringen keine Diffusion statt und es entsteht auch keine Mischungsentropie. Es ist also unzulässig, quasi in einem kontinuierlichen Grenzübergang die Gase immer ähnlicher und schließlich identisch werden zu lassen – siehe Gibbssches Paradoxon.
Statistische BeschreibungWährend in der Thermodynamik die Zustandsgleichungen als reine empirische Gleichungen eingeführt werden, können diese mit den Mitteln der statistischen Physik direkt aus der mikroskopischen Beschreibung des Systems als Ansammlung einzelner Gaspartikel gewonnen werden. Außer den oben beschriebenen Annahmen des Modells selber wird dabei keine weitere Näherung benötigt. Die Möglichkeit der exakten mathematischen Beschreibung ist mit der Hauptgrund warum das ideale Gas als einfachstes Gasmodell eine breite Anwendung findet und als Ausgangspunkt für bessere Modelle dient. Zustandssumme des idealen GasesHier soll die statistische Beschreibung des idealen Gases mit Hilfe des kanonischen Ensembles erfolgen. Dazu betrachtet man ein System aus N Teilchen in einem Volumen V bei konstanter Temperatur T. Alle thermodynamischen Relationen lassen sich aus der kanonischen Zustandssumme berechnen, welche wie folgt definiert ist: Dabei ist ein Zustand des Systems und die dazugehörige Energie. ri ist der Ort und pi der Impuls des i-ten Teilchens. Für freie, nicht wechselwirkende Teilchen ist die Energie unabhängig vom Ort der Teilchen und ergibt sich als Summe aus den kinetischen Energien der Teilchen: Anstatt die Zustandssumme direkt auszuwerten, kann sie einfacher durch ein Integral über den Phasenraum berechnet werden. Der zusätzliche Faktor 1 / N! berücksichtigt die Ununterscheidbarkeit der Gasteilchen. Die Ortsraumintegration lässt sich elementar ausführen, da der Integrand nicht vom Ort abhängt. Weiterhin zerfällt die Exponentialfunktion in einzelne Faktoren für jede Impulskomponente. Man erhält so 3N Integrale der Form welches als Gauß’sches Integral bekannt ist und die oben angegebene Lösung besitzt. Letztlich erhält man für die kanonische Zustandssumme des idealen Gases wobei im letzten Schritt die thermische Wellenlänge eingeführt wurde. Die Zustandssumme hat die Eigenschaft, dass sie sich auch direkt aus der Zustandssumme eines einzelnen Teilchens berechnet lässt: Diese Besonderheit ist jedem idealen System in der statistischen Physik zu eigen und ist Ausdruck des Fehlens von Wechselwirkungen zwischen den Gasteilchen. Ein besseres Gasmodell, welches diese Wechselwirkungen berücksichtigen will, muss demnach zusätzlich abhängig von mindestens der 2-Teilchen-Zustandssumme sein. Ableitung der ZustandsgleichungenDas der kanonischen Zustandssumme zugeordnete thermodynamische Potential ist die freie Energie Aus der freien Energie lassen sich nun alle thermodynamischen Relationen ableiten. Insbesondere soll dies hier für die thermische und kalorische Zustandsgleichung demonstriert werden. Die thermische Zustandsgleichung ergibt sich aus was durch Umstellen in die bekannte Form der idealen Gasgleichung gebracht werden kann
kann die kalorische Zustandsgleichung bestimmt werden. Diese erhält man jedoch durch Zusammenführen der obigen Gleichungen auch direkt aus der Zustandssumme Mit ergibt sich dann schließlich GültigkeitsbereichUnter den realen Gasen kommen die leichten Edelgase und Wasserstoff diesem Zustand am nächsten, insbesondere bei niedrigem Druck und hoher Temperatur, da sie im Vergleich zu ihrer mittleren freien Weglänge eine verschwindend kleine Ausdehnung besitzen. Die Geschwindigkeitsverteilung der Teilchen in einem idealen Gas wird durch die Maxwell-Boltzmann-Verteilung beschrieben. Je niedriger der Druck und je höher die Temperatur ist, desto stärker verhält sich ein reales Gas wie ein ideales. Als quantitative Vergleichsgröße muss hier der kritische Punkt herangezogen werden: Ein reales Gas verhält sich dann wie ein ideales, wenn sein Druck klein gegenüber dem kritischen Druck bzw. seine Temperatur groß gegenüber der kritischen Temperatur ist. Ideale Gase unterliegen nicht dem Joule-Thomson-Effekt, woraus man folgern kann, das ihre innere Energie und ihre Enthalpie unabhängig von Druck und Volumen sind. Der Joule-Thomson-Koeffizient beträgt daher bei idealen Gasen immer Null und die Inversionstemperatur (Tiγ = 1) hat keinen diskreten Wert, erstreckt sich also über den gesamten Temperaturbereich. ErweiterungenIdeales mehratomiges GasMöchte man mit dem idealen Gasmodell mehratomige Gaspartikel, also Moleküle, beschreiben, so kann das durch eine Erweiterung der kalorischen Zustandsgleichung geschehen Dabei gibt f die Anzahl der Freiheitsgrade pro Teilchen an. Moleküle haben neben den drei Translationsfreiheitsgraden weitere Freiheitsgrade für Rotationen und Schwingungen. Jede Schwingung hat dabei zwei Freiheitsgrade. Beispielsweise besitzt ein zweiatomiges Gas insgesamt 7 Freiheitsgrade, nämlich
Da in der Natur die Rotations- und Schwingungsfrequenzen von Molekülen gequantelt sind, wird eine gewisse Mindestenergie benötigt, um diese anzuregen. Unter Normalbedingungen reicht die thermische Energie nur, um in einem zweiatomigen Molekül Rotationen anzuregen, Schwingungen sind erst bei höheren Temperaturen anregbar. Aus dem gleichen Grund tritt der theoretisch vorhandene dritte Rotationsfreiheitsgrad für Rotationen um die Verbindungslinie in der Praxis nicht auf, da die dazu nötigen Energien ausreichten, um das Molekül zu dissoziieren. Hier lägen dann wieder einatomige Gaspartikel vor. Relativistisches ideales GasWenn die Temperaturen so groß werden, dass die mittleren Geschwindigkeiten der Gaspartikel mit der Lichtgeschwindigkeit vergleichbar werden, so muss die relativistische Massenzunahme der Teilchen berücksichtigt werden. Dieses Modell lässt sich ebenfalls gut theoretisch beschreiben, allerdings ist ein reales Gas im Regelfall bei sehr hohen Temperaturen bereits ein Plasma, d. h. die vorher elektrisch neutralen Gaspartikel liegen getrennt als Elektronen und Ionen vor. Da die Wechselwirkung zwischen Elektronen und Ionen aber wesentlich stärker als zwischen neutralen Teilchen ist, kann die Modellvorstellung eines idealen Gases nur begrenzten Aufschluss über die Physik von heißen Plasmen liefern. Ideales QuantengasJede Art von Materie besteht letztendlich aus Elementarteilchen, die entweder Fermionen oder Bosonen sind. Bei Fermionen und Bosonen muss immer die sogenannte Austauschwechselwirkung berücksichtigt werden, was die statistische Beschreibung des Systems ändert. Ein ideales Gas ist im Grunde genommen also immer entweder ein ideales Fermigas oder ein ideales Bosegas. Die Quantennatur eines Gases wird jedoch erst spürbar, wenn die mittlere freie Weglänge der Gaspartikel vergleichbar oder kleiner als ihre thermischen Wellenlänge wird. Dieser Fall gewinnt folglich bei tiefen Temperaturen oder sehr hohen Drücken an Bedeutung. Ideale Quantengase haben ein sehr breites Anwendungsspektrum gefunden. Beispielsweise können die Leitungselektronen in Metallen hervorragend durch das ideale Fermigas beschrieben werden. Die Hohlraumstrahlung und das Plancksche Strahlungsgesetz eines schwarzen Körpers hingegen kann durch das ideale Photonengas – welches ein besonderes (masseloses) ideales Bosegas ist – ausgezeichnet erklärt werden. Ideale Bosegase können zudem bei sehr tiefen Temperatur einen Phasenübergang zu Bose-Einstein-Kondensaten zeigen. Van-der-Waals GasReale Gase werden besser durch das sogenannte Van-der-Waals-Gas beschrieben, welches die immer vorhandenen Van-der-Waals-Kräfte zwischen den Gaspartikeln und zusätzlich deren Eigenvolumen berücksichtigt. Die Van-der-Waals-Gleichung modifiziert die ideale Gasgleichung um zwei entsprechende Zusatzterme. In der statistischen Beschreibung kann diese Gleichung durch die sogenannte Virialentwicklung gewonnen werden. Siehe auchFür ideale Gasgemische siehe Gasgemisch Quellen
|
|||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Ideales_Gas aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||






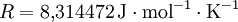 die Gaskonstante bezeichnet.
Mithilfe dieser Gleichung und den Hauptsätzen der Thermodynamik lassen sich die thermodynamischen Prozesse von idealen Gasen mathematisch beschreiben.
die Gaskonstante bezeichnet.
Mithilfe dieser Gleichung und den Hauptsätzen der Thermodynamik lassen sich die thermodynamischen Prozesse von idealen Gasen mathematisch beschreiben.
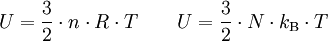
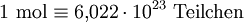 .
.
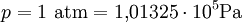 und
und 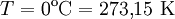 ) ergibt sich aus der allgemeinen Gasgleichung zu:
) ergibt sich aus der allgemeinen Gasgleichung zu:
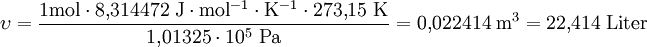
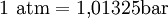 in einem Volumen von 22,414 Litern enthalten ist (Messbar aus der Gewichtsdifferenz eines gasgefüllten und eines evakuierten Kolbens).
in einem Volumen von 22,414 Litern enthalten ist (Messbar aus der Gewichtsdifferenz eines gasgefüllten und eines evakuierten Kolbens).
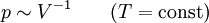
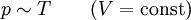
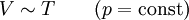
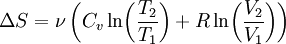
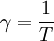
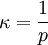
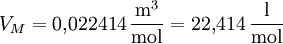
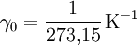
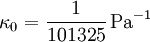
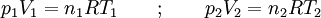
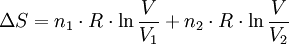
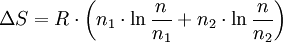
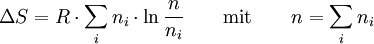
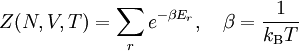
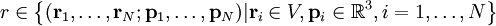
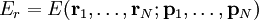
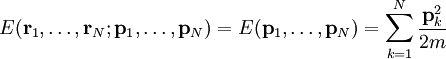
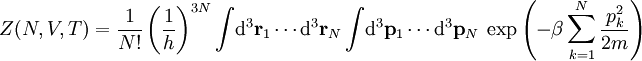
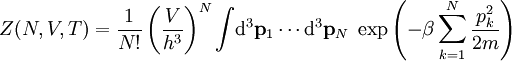
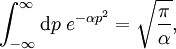
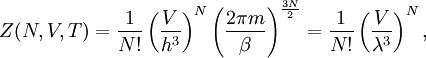
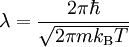
![Z(N,V,T)=\frac{1}{N!}\left[Z(1,V,T)\right]^N.](images/math/2/6/4/264d2573f9236ab77f560f54c058a6f5.png)